早教吧作业答案频道 -->化学-->
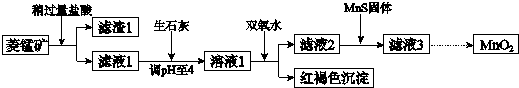
工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如图:已知:生成氢氧化物沉淀的pHMn(OH)2Fe(OH)2Fe(OH)3Cu(OH)2开始沉
题目详情
工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如图:
已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是___.
盐酸溶解MnCO3的化学方程式是___.
(2)向溶液1中加入双氧水时,反应的离子方程式是___.
(3)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+□___=□___+□___+□___.
(4)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是___.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是___.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是___.

已知:生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是___.
盐酸溶解MnCO3的化学方程式是___.
(2)向溶液1中加入双氧水时,反应的离子方程式是___.
(3)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+□___=□___+□___+□___.
(4)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是___.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是___.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是___.
▼优质解答
答案和解析
菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有氯化镁、氯化亚铁、氯化铜及剩余的HCl,向滤液中加入生石灰,调节溶液pH=4,加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液2中加入MnS,将溶液中Cu2+氧化为CuS沉淀过滤除去,滤液3中为MnCl2,系列转化得到MnO2.
(1)将菱锰矿粉碎,可以增大接触面积,提高反应速率;碳酸镁与盐酸反应生成氯化镁、二氧化碳与水,反应方程式为:MnCO3+2HCl=MnCl2+CO2↑+H2O,
故答案为:增大接触面积,提高反应速率;MnCO3+2HCl=MnCl2+CO2↑+H2O;
(2)加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,根据电荷守恒有氢离子生成,反应离子方程式为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+,
故答案为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)用酸化的NaClO3溶液将MnCl2氧化得到MnO2,Mn元素发生氧化反应,则Cl元素发生还原反应生成Cl2,由于在酸性条件下反应,根据电荷守恒可知,生成物中有H+生成,根据H元素守恒,可知反应物中缺项物质为H2O,配平后离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+,
故答案为:4H2O;Cl2↑;5MnO2;8H+;
(4)①由题意可知,Mn2+转化为MnO2,发生氧化反应,由O元素守恒可知有水参加反应,由电荷守恒可知应有H+生成,电极反应式为:Mn2+-2e-+2H2O=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
②生成氯气发生氧化反应,在阳极产生,检验Cl2的操作是:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成,
故答案为:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成;
③Mn2+、Cl-都在阳极放电,二者为竞争关系,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电),
故答案为:其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).
(1)将菱锰矿粉碎,可以增大接触面积,提高反应速率;碳酸镁与盐酸反应生成氯化镁、二氧化碳与水,反应方程式为:MnCO3+2HCl=MnCl2+CO2↑+H2O,
故答案为:增大接触面积,提高反应速率;MnCO3+2HCl=MnCl2+CO2↑+H2O;
(2)加入过氧化氢将溶液中Fe2+氧化为Fe3+,在PH=4时氧化得到Fe3+转化为Fe(OH)3沉淀,根据电荷守恒有氢离子生成,反应离子方程式为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+,
故答案为:2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)用酸化的NaClO3溶液将MnCl2氧化得到MnO2,Mn元素发生氧化反应,则Cl元素发生还原反应生成Cl2,由于在酸性条件下反应,根据电荷守恒可知,生成物中有H+生成,根据H元素守恒,可知反应物中缺项物质为H2O,配平后离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+,
故答案为:4H2O;Cl2↑;5MnO2;8H+;
(4)①由题意可知,Mn2+转化为MnO2,发生氧化反应,由O元素守恒可知有水参加反应,由电荷守恒可知应有H+生成,电极反应式为:Mn2+-2e-+2H2O=MnO2+4H+,
故答案为:Mn2+-2e-+2H2O=MnO2+4H+;
②生成氯气发生氧化反应,在阳极产生,检验Cl2的操作是:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成,
故答案为:将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成;
③Mn2+、Cl-都在阳极放电,二者为竞争关系,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电),
故答案为:其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).
看了 工业上用菱锰矿(MnCO3)...的网友还看了以下:
矿石中氧化铁含量含氧化铁矿石20克合一定量一氧化碳充分反映生成物使澄清石灰水浑浊使石灰水质量增加9 2020-04-26 …
(10分)工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:请回答下列问题:(1)沉淀C的化学式 2020-05-14 …
近年来,硫化铜矿的湿法冶炼已经取得很大的进展.现有一种催化氧化酸浸硫化铜矿的湿法冶炼法,其工艺流程 2020-05-16 …
用王水可以提取硫化铜精矿里的铜吗?或者用其它什么方法可以把硫化铜矿里的银和铜提出来,常温常压的.哪 2020-07-01 …
一道化学题取软锰矿(主要成分是MnO2)150g,与足量浓盐酸反应,把制得的氯气通入消石灰溶液中, 2020-07-01 …
某化工厂利用氧化钴矿石制取CoC2O4(草酸钴)的工艺流程如下:(已知:黄钠铁矾不溶于水,可溶于酸) 2020-11-01 …
请解释下什么叫硫化镍矿?最好详细一点,镍矿一般分为红土镍矿、硫化镍矿,我想知道的是硫化镍矿的具体概念 2020-11-05 …
19世纪末,被认为是稀罕的贵金属铝,价格大大下降,这是因为发现了()A.大量铝土矿B.电解氧化铝制取 2021-01-18 …
19世纪末,被认为是稀罕的贵金属铝,价格大大下降,这是因为发现了()A.大量铝土矿B.电解氧化铝制取 2021-01-18 …
下列制取物质的方法正确的是A.工业上通过电解MgO制取镁B.工业上通过电解氢氧化铝制取铝C.工业上通 2021-02-16 …