早教吧作业答案频道 -->化学-->
由合成气制备乙醇一般有两种方法:(1)直接合成法①2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H1②2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g)△H2=-253.6kJ•mol-1(2)间接合成法合成气反应生成
题目详情
由合成气制备乙醇一般有两种方法:
(1)直接合成法
①2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H1
②2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g)△H2=-253.6kJ•mol-1
(2)间接合成法
合成气反应生成二甲醚(CH3OCH3),二甲醚羰基化合生成乙酸甲酯,乙酸甲酯加氢得到乙醇.其生产流程如图所示:
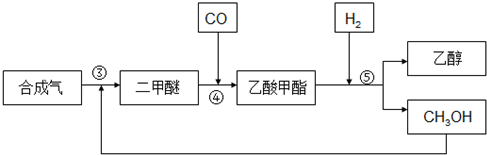
③3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2△H3=-260.2kJ•mol-1
④CH3OCH3(g)+CO(g)⇌CH3COOCH3(g)
回答下列问题:
(1)在5MPa、起始投料量n(H2):n(CO2)=3:1时,测得不同温度时反应①中各物质的平衡组成如图1所示:
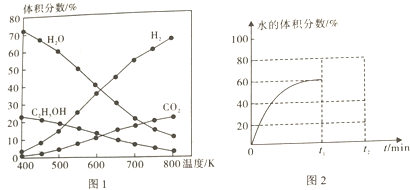
①反应①的△H1___0,△S___0.(填“>”、“<”或“=”)
②已知CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41kJ•mol-1,则△H1=___.
③500K时,反应达到平衡后,在t1min时升温到600K,反应在t2min重新达到平衡,请在图2中画出体系中水的体积分数在t1min后的变化曲线.
(2)对反应③处于化学平衡状态时的描述,正确的是___.(填字母).
A.CO的含量保持不变 B.容器中CH3OCH3浓度与CO2浓度相等
C.3V正(CO)=V正(CH3OCH3) D.体系的温度保持不变
(3)间接合成法中将甲醇(CH3OH)循环使用的目的是___.
(4)在2Mpa、T℃时1L的恒容容器中,充入1.0mol乙酸甲酯和2.0mol氢气,发生反应⑤,经t min后反应达到平衡,测得乙酸甲酯的转化率为75%.则氢气的反应速率v(H2)=___,平衡常数K=___.
(1)直接合成法
①2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H1
②2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g)△H2=-253.6kJ•mol-1
(2)间接合成法
合成气反应生成二甲醚(CH3OCH3),二甲醚羰基化合生成乙酸甲酯,乙酸甲酯加氢得到乙醇.其生产流程如图所示:

③3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2△H3=-260.2kJ•mol-1
④CH3OCH3(g)+CO(g)⇌CH3COOCH3(g)
回答下列问题:
(1)在5MPa、起始投料量n(H2):n(CO2)=3:1时,测得不同温度时反应①中各物质的平衡组成如图1所示:

①反应①的△H1___0,△S___0.(填“>”、“<”或“=”)
②已知CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41kJ•mol-1,则△H1=___.
③500K时,反应达到平衡后,在t1min时升温到600K,反应在t2min重新达到平衡,请在图2中画出体系中水的体积分数在t1min后的变化曲线.
(2)对反应③处于化学平衡状态时的描述,正确的是___.(填字母).
A.CO的含量保持不变 B.容器中CH3OCH3浓度与CO2浓度相等
C.3V正(CO)=V正(CH3OCH3) D.体系的温度保持不变
(3)间接合成法中将甲醇(CH3OH)循环使用的目的是___.
(4)在2Mpa、T℃时1L的恒容容器中,充入1.0mol乙酸甲酯和2.0mol氢气,发生反应⑤,经t min后反应达到平衡,测得乙酸甲酯的转化率为75%.则氢气的反应速率v(H2)=___,平衡常数K=___.
▼优质解答
答案和解析
(1)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)正反应为气体的体积减小的反应,所以△S<0,
故答案为:<;<;
②Ⅰ2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H1
Ⅱ2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g)△H2=-253.6kJ•mol-1
ⅢCO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41kJ•mol-1,将Ⅱ-Ⅲ×2得Ⅰ,所以△H1=(-253.6kJ•mol-1)-(-41kJ•mol-1)×2=-171.6kJ•mol-1,
故答案为:-171.6kJ•mol-1;
③2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H1=-171.6kJ•mol-1,在t1min时升温到600K,平衡逆向移动,水的体积分数下降,从图1可知达平衡时H2O%大于40%小于45%,图象为: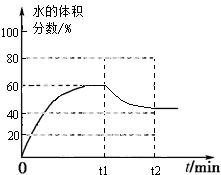 ,
,
故答案为: ;
;
(2)反应③3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2 △H3=-260.2kJ•mol-1
A.化学反应达到平衡状态时,反应混合物中各组成成分的浓度不随时间改变,CO的含量保持不变,处于化学平衡状态,故A正确;
B.因间接合成法涉及③3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2△H3=-260.2kJ•mol-1④CH3OCH3(g)+CO(g)⇌CH3COOCH3(g),容器中CH3OCH3浓度与CO2浓度相等,处于化学平衡状态,故B正确;
C.3V正(CO)=V正(CH3OCH3) 表明正反应进行,反应没有停止,不能表明处于化学平衡状态,故C错误;
D.该反应正反应为放热反应,体系的温度保持不变,表明处于化学平衡状态,故D正确;
故答案为:ABD;
(3)甲醇和浓H2SO4共热至140℃时,发生取代反应,即分子间脱水,生成二甲醚,反应方程式为:2CH3OH
CH3OCH3+H2O,既实现了甲醇的回收利用,又增加了甲醚的含量,提高了目标产物的产率,
故答案为:由于甲醇分子间脱水可生成二甲醚,既实现了甲醇的回收利用,又增加了甲醚的含量,提高了目标产物的产率;
(4)乙酸甲酯加氢得到乙醇.反应⑤为CH3COOCH3+2H2⇌CH3CH2OH+CH3OH,
CH3COOCH3+2H2⇌CH3CH2OH+CH3OH
起始(mol/L):1 2 0 0
转化(mol/L):0.75 1.5 0.75 0.75
平衡(mol/L):0.25 0.5 0.75 0.75
氢气的反应速率V(H2)=
=
mol•L-1•min-1
平衡常数K=
=
=9
故答案为:1.5/t mol•L-1•min-1;9.
故答案为:<;<;
②Ⅰ2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H1
Ⅱ2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g)△H2=-253.6kJ•mol-1
ⅢCO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41kJ•mol-1,将Ⅱ-Ⅲ×2得Ⅰ,所以△H1=(-253.6kJ•mol-1)-(-41kJ•mol-1)×2=-171.6kJ•mol-1,
故答案为:-171.6kJ•mol-1;
③2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g)△H1=-171.6kJ•mol-1,在t1min时升温到600K,平衡逆向移动,水的体积分数下降,从图1可知达平衡时H2O%大于40%小于45%,图象为:
 ,
,故答案为:
 ;
;(2)反应③3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2 △H3=-260.2kJ•mol-1
A.化学反应达到平衡状态时,反应混合物中各组成成分的浓度不随时间改变,CO的含量保持不变,处于化学平衡状态,故A正确;
B.因间接合成法涉及③3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2△H3=-260.2kJ•mol-1④CH3OCH3(g)+CO(g)⇌CH3COOCH3(g),容器中CH3OCH3浓度与CO2浓度相等,处于化学平衡状态,故B正确;
C.3V正(CO)=V正(CH3OCH3) 表明正反应进行,反应没有停止,不能表明处于化学平衡状态,故C错误;
D.该反应正反应为放热反应,体系的温度保持不变,表明处于化学平衡状态,故D正确;
故答案为:ABD;
(3)甲醇和浓H2SO4共热至140℃时,发生取代反应,即分子间脱水,生成二甲醚,反应方程式为:2CH3OH
| 浓硫酸 |
| 140℃ |
故答案为:由于甲醇分子间脱水可生成二甲醚,既实现了甲醇的回收利用,又增加了甲醚的含量,提高了目标产物的产率;
(4)乙酸甲酯加氢得到乙醇.反应⑤为CH3COOCH3+2H2⇌CH3CH2OH+CH3OH,
CH3COOCH3+2H2⇌CH3CH2OH+CH3OH
起始(mol/L):1 2 0 0
转化(mol/L):0.75 1.5 0.75 0.75
平衡(mol/L):0.25 0.5 0.75 0.75
氢气的反应速率V(H2)=
| △C |
| △t |
| 1.5 |
| t |
平衡常数K=
| C(CH3CH2OH)×C(CH3OH) |
| C(CH3COOCH3)×C2(H2) |
| 0.75×0.75 |
| 0.25×0.52 |
故答案为:1.5/t mol•L-1•min-1;9.
看了 由合成气制备乙醇一般有两种方...的网友还看了以下:
1.Fe(OH)3胶体的制法2.58.5g的氯化钠固体中含有NA个氯化钠分子.为什么错.3.铝,空 2020-05-02 …
(2013•永州一模)科学研究发现Cu2O可作为太阳光分解水的催化剂.Ⅰ.通过以下四种方法来制备C 2020-05-04 …
一、单选题(共 15 道试题,共 45 分.)1.从操纵和控制变量的程度上看 ,心理学研究方法不包 2020-05-16 …
化学问题.请在15分钟内回答.回答O2的反应原理是什么?1.2.3H2的反应原理是什么?1.2CO 2020-06-06 …
用NaAc.3H2O晶体,2.0mol/lNAOH来配制PH=2.0HAC。NaAc缓冲溶液1升正 2020-06-13 …
纯碱(Na2CO3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下:实验室制备纯碱(1) 2020-06-18 …
将食物及其相应的保鲜方法搭配:1.蘑菇a.晒制与烟熏法2.咸鱼b.脱水法3.肉类罐头c.腌制法4. 2020-07-24 …
在制定网络安全策略时有以下两种思想方法:方法1):凡是没有明确表示允许的就要被禁止。方法2):凡是没 2020-11-08 …
急急1给你一块教学用的量角器、一根细线、一个小铁块,要求自制一个简易的s水平仪(1)简要说明它的制法 2020-11-21 …
之所以说《十二铜表法》的制定是平民的胜利,主要因为1.它是罗马第一部成文法2.它是在平民的要求和斗争 2020-12-18 …