早教吧作业答案频道 -->化学-->
甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用甲烷氧化法合成甲醇的反应有:ⅠCH4(g)+CO2(g)⇌2CO(g)+2H2(g)△H1=+247.3kJ•mol-1ⅡCO(g)+2H2(g)⇌CH3OH(g)△H2=-90.1kJ
题目详情
甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用甲烷氧化法合成甲醇的反应有:
ⅠCH4(g)+CO2(g)⇌2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
ⅡCO(g)+2H2(g)⇌CH3OH(g)△H2=-90.1kJ•mol-1
Ⅱ2CO(g)+O2(g)⇌2CO2(g)△H3=-566.0kJ•mol-1
(1)用CH4和O2直接制备甲醇蒸气的热化学方程式为___.
(2)某温度下,向4L恒容密闭容器中通入6mol CO2和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为
,则此温度下该反应的平衡常数K=___,CH4的转化率为___.
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g)⇌HCOOCH3(g)
科研人员对该反应进行了研究,部分研究结果如下:
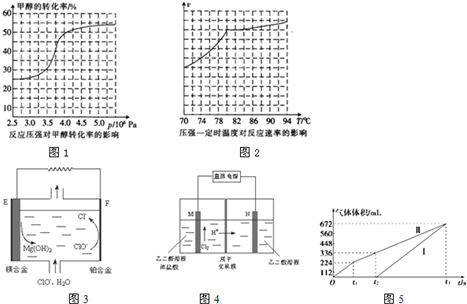
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是___(填“3.5×106Pa““4.O×106Pa“或“5.0×106Pa”).
②实际工业生产中采用的温度是80℃,其理由是___.
(4)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.图3为“镁-次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金.
①E为该燃料电池的___极(填“正”或“负”).F电极上的电极反应式为___.
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因___.
(5)乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两级室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.
①N电极上的电极反应式为___.
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为___mol.
(6)常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图5所示,根据图5中信息回答下列问题.( 气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
①曲线___ (填Ⅰ或Ⅱ)表示阳极产生气体的变化;
②NaCl的物质的量浓度为___.CuSO4的物质的量浓度为___.
③t2时所得溶液的pH为___.
ⅠCH4(g)+CO2(g)⇌2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
ⅡCO(g)+2H2(g)⇌CH3OH(g)△H2=-90.1kJ•mol-1
Ⅱ2CO(g)+O2(g)⇌2CO2(g)△H3=-566.0kJ•mol-1
(1)用CH4和O2直接制备甲醇蒸气的热化学方程式为___.
(2)某温度下,向4L恒容密闭容器中通入6mol CO2和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为
| 1 |
| 4 |
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g)⇌HCOOCH3(g)
科研人员对该反应进行了研究,部分研究结果如下:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是___(填“3.5×106Pa““4.O×106Pa“或“5.0×106Pa”).
②实际工业生产中采用的温度是80℃,其理由是___.
(4)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.图3为“镁-次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金.
①E为该燃料电池的___极(填“正”或“负”).F电极上的电极反应式为___.
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因___.
(5)乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两级室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.
①N电极上的电极反应式为___.
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为___mol.
(6)常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图5所示,根据图5中信息回答下列问题.( 气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
①曲线___ (填Ⅰ或Ⅱ)表示阳极产生气体的变化;
②NaCl的物质的量浓度为___.CuSO4的物质的量浓度为___.
③t2时所得溶液的pH为___.
▼优质解答
答案和解析
(1)根据(Ⅰ)CH4(g)+CO2(g)⇌2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
(Ⅱ)CO(g)+2H2(g)⇌CH3OH(g)△H2=-90.1kJ•mol-1
(Ⅲ)2CO(g)+O2(g)⇌2CO2(g)△H3=-566.0kJ•mol-1
由(Ⅰ)×2+(Ⅱ)×2+(Ⅲ)得2CH4(g)+O2(g)⇌2CH3OH(g)△H,故△H=2△H1+2△H2+△H3=(+247.3kJ•mol-1)×2+(-90.1kJ•mol-1)×2+(-566.0kJ•mol-1)=-251.6kJ•mol-1,所以用CH4和O2直接制备甲醇蒸气的热化学方程式为2CH4(g)+O2(g)⇌2CH3OH(g)△H=-251.6kJ•mol-1,故答案为:2CH4(g)+O2(g)⇌2CH3OH(g)△H=-251.6kJ•mol-1;
(2)CH4(g)+CO2(g)⇌2CO(g)+2H2(g)
起始(mol) 6 6 0 0
变化(mol) x x 2x 2x
平衡(mol)6-x 6-x 2x 2x
平衡体系中各组分的体积分数均为
,所以6-x=2x,解得x=2,
则此温度下该反应的平衡常数K=
=
=1,
CH4的转化率为
=33.3%,故答案为:1;33.3%;
(3)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率变化最大的是4.0×106Pa,故答案为:4.0×106Pa;
②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,
故答案为:高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低;
(4)①“镁-次氯酸盐”燃料电池中失电子的为负极,则Mg为负极;正极上ClO-得电子生成氯离子,则正极的电极反应式为:ClO-+2e-+H2O═Cl-+2OH-;故答案为:负;ClO-+2e-+H2O═Cl-+2OH-;
②Mg的活泼性较强能与水反应生成氢气,其反应为:Mg+2H2O═Mg(OH)2+H2↑,故答案为:Mg+2H2O═Mg(OH)2+H2↑;
(5)①N电极上HOOC-COOH得电子生成HOOC-CHO,则电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,故答案为:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O;
②2mol H+通过质子交换膜,则电池中转移2mol电子,根据电极方程式HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,可知生成1mol乙醛酸,由于两极均有乙醛酸生成所以生成的乙醛酸为2mol;故答案为:2;
(6)①电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,所以阳极上先产生气体,曲线Ⅱ表示阳极产生气体的变化,故答案为:Ⅱ;
②结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系①由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=
×2=0.02mol,所以c(NaCl)=
=0.1mol/L,
由t2时生成氧气为112mL,n(O2)=
=0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,
根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=
=0.02mol,所以c(CuSO4)=
=0.1mol/L,
故答案为:0.1mol/L;0.1mol/L;
③由t2时4OH--4e-=O2↑+2H2O~4H+,n(H+)=0.005mol×4=0.02mol,则溶液的c(H+)=
=0.1mol/L,pH=1,故答案为:1.
(Ⅱ)CO(g)+2H2(g)⇌CH3OH(g)△H2=-90.1kJ•mol-1
(Ⅲ)2CO(g)+O2(g)⇌2CO2(g)△H3=-566.0kJ•mol-1
由(Ⅰ)×2+(Ⅱ)×2+(Ⅲ)得2CH4(g)+O2(g)⇌2CH3OH(g)△H,故△H=2△H1+2△H2+△H3=(+247.3kJ•mol-1)×2+(-90.1kJ•mol-1)×2+(-566.0kJ•mol-1)=-251.6kJ•mol-1,所以用CH4和O2直接制备甲醇蒸气的热化学方程式为2CH4(g)+O2(g)⇌2CH3OH(g)△H=-251.6kJ•mol-1,故答案为:2CH4(g)+O2(g)⇌2CH3OH(g)△H=-251.6kJ•mol-1;
(2)CH4(g)+CO2(g)⇌2CO(g)+2H2(g)
起始(mol) 6 6 0 0
变化(mol) x x 2x 2x
平衡(mol)6-x 6-x 2x 2x
平衡体系中各组分的体积分数均为
| 1 |
| 4 |
则此温度下该反应的平衡常数K=
| c2(CO)×c2(H2) |
| c(CH4)×c(CO2) |
| 12×12 |
| 1×1 |
CH4的转化率为
| 2 |
| 6 |
(3)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率变化最大的是4.0×106Pa,故答案为:4.0×106Pa;
②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,
故答案为:高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低;
(4)①“镁-次氯酸盐”燃料电池中失电子的为负极,则Mg为负极;正极上ClO-得电子生成氯离子,则正极的电极反应式为:ClO-+2e-+H2O═Cl-+2OH-;故答案为:负;ClO-+2e-+H2O═Cl-+2OH-;
②Mg的活泼性较强能与水反应生成氢气,其反应为:Mg+2H2O═Mg(OH)2+H2↑,故答案为:Mg+2H2O═Mg(OH)2+H2↑;
(5)①N电极上HOOC-COOH得电子生成HOOC-CHO,则电极反应式为HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,故答案为:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O;
②2mol H+通过质子交换膜,则电池中转移2mol电子,根据电极方程式HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,可知生成1mol乙醛酸,由于两极均有乙醛酸生成所以生成的乙醛酸为2mol;故答案为:2;
(6)①电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,所以阳极上先产生气体,曲线Ⅱ表示阳极产生气体的变化,故答案为:Ⅱ;
②结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系①由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=
| 0.224L |
| 22.4L/mol |
| 0.02mol |
| 0.2L |
由t2时生成氧气为112mL,n(O2)=
| 0.112L |
| 22.4L/mol |
根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=
| 0.04mol |
| 2 |
| 0.02mol |
| 0.2L |
故答案为:0.1mol/L;0.1mol/L;
③由t2时4OH--4e-=O2↑+2H2O~4H+,n(H+)=0.005mol×4=0.02mol,则溶液的c(H+)=
| 0.02mol |
| 0.2L |
看了 甲醇是一种重要的化工原料,在...的网友还看了以下:
化合物E(含两种元素)与NH3反应,生成化合物G和H2,化合物G的相对分子量约为81,G分子中硼元 2020-05-16 …
化合物E(含两种元素)与NH3反应生成化合物G和H2,G的式量为81.G分子中含硼元素40%、氢元 2020-07-05 …
由合成气制备乙醇一般有两种方法:(1)直接合成法①2CO2(g)+6H2(g)⇌CH3CH2OH( 2020-07-19 …
甲醇是一种重要的化工原料,在生产中有着重要的应用,工业上用甲烷氧化法合成甲醇的反应有:(Ⅰ)CH4 2020-07-19 …
甲醇是一种重要的化工原料,在生产中有着重要的应用.工业上用甲烷氧化法合成甲醇的反应有:ⅠCH4(g 2020-07-19 …
甲醇是一种重要的化工原料,在生产中有着重要应用.工业上用甲烷氧化法合成甲醇,反应流程中涉及如下反应 2020-07-19 …
化合物G是一种治疗认知障碍药物的中间体,可以通过以下方法合成:(1)化合物A、D中含氧官能团的名称 2020-07-23 …
甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景.工业上可用如下方法合成甲醇: 2020-11-04 …
甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景.工业上可用如下方法合成甲醇: 2020-11-22 …
在某容积一定的密闭容器中,可逆反应:A(g)+B(g)XC(g)符合如图像(Ⅰ)所示关系。由此推断对 2020-12-07 …