早教吧作业答案频道 -->化学-->
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=akJ•mol-1CO(g)+H2O(g)=CO2(g)+H2(g)△H2=b
题目详情
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=a kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H2=b kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=c kJ•mol-1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=___kJ•mol-1.
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
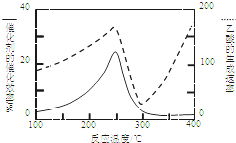
①在不同温度下催化剂的催化效率与乙酸的生成速率如图8所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是___.
②为了提高该反应中CH4的转化率,可以采取的措施是___.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___.
(3)以CO2为原料可以合成多种物质.
①利用FeO吸收CO2的化学方程式为:6FeO+CO2=2Fe3O4+C,则反应中每生成1molFe3O4,转移电子的物质的量为___mol.
②以氢氧化钾水溶液作电解质进行电解,在铜电极上CO2可转化为CH4,另一电极石墨连接电源的___极,则该电解反应的化学方程式为___.

(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=a kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g)△H2=b kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=c kJ•mol-1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=___kJ•mol-1.
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①在不同温度下催化剂的催化效率与乙酸的生成速率如图8所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是___.
②为了提高该反应中CH4的转化率,可以采取的措施是___.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___.
(3)以CO2为原料可以合成多种物质.
①利用FeO吸收CO2的化学方程式为:6FeO+CO2=2Fe3O4+C,则反应中每生成1molFe3O4,转移电子的物质的量为___mol.
②以氢氧化钾水溶液作电解质进行电解,在铜电极上CO2可转化为CH4,另一电极石墨连接电源的___极,则该电解反应的化学方程式为___.
▼优质解答
答案和解析
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=akJ•mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=bkJ•mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=ckJ•mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)⇌2CO(g)+2H2(g)△H=(a+2b‒2c)kJ•mol-1.
故答案为:a+2b‒2c;
(2)①由于催化剂的催化效率受温度影响大,所以250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低,
故答案:温度超过250℃时,催化剂的催化效率降低;
②该反应是体积减小的可逆反应,所以为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强或增大CO2的浓度,
故答案为:增大反应压强或增大CO2的浓度;
③硝酸是氧化性酸,稀硝酸的还原产物是NO,则根据电子得失守恒和原子守恒可知Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16 H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O;
(3)①根据方程式6FeO+CO2=2Fe3O4+C可知反应中每生成1molFe3O4,消耗0.5molCO2.其中碳元素的化合价从+4价降低到0价,则转移电子的物质的量为2mol,
故答案为:2;
②铜是活性电极,如果在铜电极上CO2可转化为CH4,这说明铜电极是阴极,则另一电极石墨连接电源的正极,该电极是阳极,溶液中的氢氧根失去电子转化为氧气,则该电解反应的化学方程式为CO2+2H2O
CH4+2O2,
故答案为:正;CO2+2H2O
CH4+2O2.
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=bkJ•mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=ckJ•mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)⇌2CO(g)+2H2(g)△H=(a+2b‒2c)kJ•mol-1.
故答案为:a+2b‒2c;
(2)①由于催化剂的催化效率受温度影响大,所以250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低,
故答案:温度超过250℃时,催化剂的催化效率降低;
②该反应是体积减小的可逆反应,所以为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强或增大CO2的浓度,
故答案为:增大反应压强或增大CO2的浓度;
③硝酸是氧化性酸,稀硝酸的还原产物是NO,则根据电子得失守恒和原子守恒可知Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16 H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O;
(3)①根据方程式6FeO+CO2=2Fe3O4+C可知反应中每生成1molFe3O4,消耗0.5molCO2.其中碳元素的化合价从+4价降低到0价,则转移电子的物质的量为2mol,
故答案为:2;
②铜是活性电极,如果在铜电极上CO2可转化为CH4,这说明铜电极是阴极,则另一电极石墨连接电源的正极,该电极是阳极,溶液中的氢氧根失去电子转化为氧气,则该电解反应的化学方程式为CO2+2H2O
| ||
故答案为:正;CO2+2H2O
| ||
看了 CO2和CH4是两种重要的温...的网友还看了以下:
求三道函数题目.职高难度.1、已知函数f(x)=ax+c,f(1)=1,f(2)=4.求a与c的值 2020-06-26 …
已知函数f(x)=ax的平方+2x+c(x属于r)满足f(x+1=ax的平方+4.(1)求f(x) 2020-07-14 …
已知:C(s)+H2O(g)═CO(g)+H2(g)△H1=+131.3kJ•mol-1C(s)+ 2020-07-17 …
(1)298K时,由氢气和氧气反应生成lmol水蒸气放热241.8kJ,写出该反应的热化学方程式H 2020-07-19 …
已知:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,2H2(g)+O2(g)═ 2020-07-19 …
对于反应A(g)+B(g)C(g)+D(g)在密闭容器里已达到平衡此时向容器内充入A气体,使其浓度增 2020-11-03 …
CO和H2与我们的生产和生活等方面密切相关.(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的 2020-11-20 …
(1)已知断裂1molH-H键、1molN≡N键分别需要吸收436kJ、946kJ的能量,生成1mo 2021-02-16 …
已知C、CO的燃烧热分别为393.5kj/mol、283.0kJ/mol,则碳与CO2反应的热化学方 2021-02-17 …
(1)已知:C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1H2(g)+12O2 2021-02-17 …