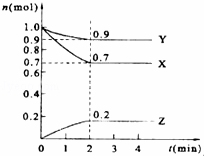
某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.(1)由图中所给数据进行分析,该反应的化学方程式为.(2)反应从开始至2分钟
某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.
(1)由图中所给数据进行分析,该反应的化学方程式为 .
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为 .
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n 始 :n 平 = 10 .
(4)达到平衡时,X和Y的转化率之比,α(X):α(Y)= .
(5)平衡时,Z的体积分数为 (保留两位有效数字).
(6)反应达到平衡后,下列措施能加快化学反应速率的有 (填序号,多选或少选无分).
A.增大反应物的浓度 B.升高温度 C.使用正催化剂
(7)下列叙述能说明上述反应达到平衡状态的是 (填序号,多选或少选无分).
A.X、Y、Z的物质的量之比为3:1:2
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的总物质的量不随时间的变化而变.
考点:
化学平衡的计算;化学反应速率的影响因素;化学平衡状态的判断.
分析:
(1)判断出反应物和生成物,根据物质的量变化之比等于化学剂量数之比确定反应的化学方程式; (2)根据v=计算反应速率; (3)在相同温度下,依据图象计算起始气体物质的量和平衡状态气体物质的量,得到原混合气体与平衡混合气体的总物质的量之比; (4)转化率=×100%; (5)反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,Z物质的量0.2mol,计算平衡时Z的体积分数; (6)根据影响化学反应速率的影响条件分析,改变条件平衡向减弱这种改变的方向进行; (7)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
(1)在反应中,X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,则X、Y为反应物,Z为生成物,相同时间内物质的量的变化比值为:c(Y):c(X):c(Z)=(1.0﹣0.9):(1.0﹣0.7):0.2=1:3:2,化学反应中物质的量变化之比等于化学剂量数之比,则化学方程式为Y+3X⇌2Z, 故答案为:Y+3X⇌2Z; (2)反应开始至2min,气体Z的平均反应速率为v===0.05mol/(L.min),故答案为:0.05mol/(L.min); (3)反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol, 起始时气体的总物质的量为:1.0mol+1.0mol=2.0mol, 原混合气体与平衡混合气体的总物质的量之比=2.0:1.8=10:9, 故答案为:10:9; (4)X转化率=×100%=×100%=30% Y转化率=×100%=×100%=10% 达到平衡时,X和Y的转化率之比,α(X):α(Y)=30%:10%=3:1, 故答案为:3:1; (5)反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,Z物质的量0.2mol,平衡时,Z的体积分数=×100%=11.1%, 故答案为:11.1%; (6)2min末达到化学平衡状态;增大反应物的浓度、升高温度、使用正催化剂都可以加快化学反应速率,故答案为:ABC; (7)A、物质的量之比为1:3:2,而不是量之比不变,不能说明反应达到平衡状态,故A错误; B、反应前后气体体积分数变化,混合气体的压强不随时间的变化而变化,三者的浓度不再变化,达到了平衡,故B正确; C、单位时间内生成2mol Z,则要消耗3mol X,未体现正与逆的关系,不能说明是否达到平衡,故C错误; D.反应前后气体质量始终不变,混合气体的总质量不随时间的变化而变化,不能说明反应达到平衡状态,故D错误; E.反应前后气体物质的量分数改变,当混合气体的总物质的量不随时间的变化而变,说明反应达到平衡状态,故E正确; 故选BE.
点评:
本题考查了化学平衡影响因素分析,平衡计算应用,该题通过图象中物质的物质的量的变化,来考查化学平衡的移动、化学反应速率计算,综合考查学生对知识的综合应用能力,题目难度中等.
对磁盘进行调度时,下列说法错误的是( )。 A.磁盘调度由“移臂调度”和“旋转调度”组成 B.最短寻 2020-05-23 …
操作系统计算题设某系统采用可抢占的优先级进程调度算法,在系统的就绪队列中有P1、p2、p3三个进程 2020-06-12 …
黑洞的质量很大什么都逃不出去,光也不例外,那当黑洞牵引光前进时,速度是否比纯粹的光速快,或是光子超 2020-06-19 …
如图所示,质量为2kg的物体在长4m的斜面顶端由静止下滑,然后进入由圆弧与斜面连接的水平面(由斜面 2020-06-28 …
一艘轮船由南向北以15海里/时的速度航行,在A处测得小岛P在西偏北75度方向上,两小时后,轮船在B 2020-07-02 …
应用题------方程解!一列火车长235米,速度为60千米一小时,一越野车长5米,速度为80千米 2020-07-19 …
一列火车长240米,速度为60千米每时,一辆越野车的速度为80千米每时,当火车行进时,越野车与火车 2020-07-20 …
如图是某小组绘制的海波熔化时温度随时间变化规律的图象.由图象可知海波的熔点是℃,熔化过程经历了分钟 2020-07-21 …
操作系统进程调度设某系统采用可抢占的优先级进程调度算法,在系统的就绪队列中有P1、p2、p3三个进程 2020-11-08 …
质量为4000kg的汽车,由静止开始以恒定的功率前进,它经100/3s的时间前进425m,这时它达到 2020-11-30 …