早教吧作业答案频道 -->化学-->
某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/LNaOH溶液(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体gⅡ.测定稀硫酸和稀氢氧化钠中
题目详情
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体___g
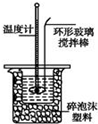
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):___.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写表中的空白:
②近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=___(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母).
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
Ⅰ.配制0.50mol/L NaOH溶液

(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体___g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):___.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母).
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
▼优质解答
答案和解析
Ⅰ、(1)需要称量NaOH固体m=nM=cVM=0.5mol/L×0.5L×40g/mol=5.0g,故答案为:5.0;
Ⅱ(1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和氢氧化钠稀溶液反应的热化学方程式为:
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:
H2SO4(aq)+NaOH(aq)=
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(2)①4次温度差分别为:4.2℃,3.8℃,3.9℃,4.1℃,4组数据都有效,温度差平均值=
=
=4.0℃,
故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-
=-53.5 kJ/mol,
故答案为:-53.5kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd.
Ⅱ(1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和氢氧化钠稀溶液反应的热化学方程式为:
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:
| 1 |
| 2 |
| 1 |
| 2 |
(2)①4次温度差分别为:4.2℃,3.8℃,3.9℃,4.1℃,4组数据都有效,温度差平均值=
| 四次实验中(终止温度-初始温度)的和 |
| 4 |
| 4.2°C+3.8°C+3.9°C+4.1°C |
| 4 |
故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-
| 1.3376KJ |
| 0.025mol |
故答案为:-53.5kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd.
看了 某实验小组用0.50mol/...的网友还看了以下:
有人建议把H元素排在元素周期表的7主族.下列事实能支持这观点的是1.H原子得到一个电子就可以达到稳 2020-05-24 …
直线的斜率角和斜率1.若经过点P(1-a,1+a)和Q(3,2a)的直线的倾斜率角为锐角,求实数a 2020-06-04 …
哈122中期中考试数学题.知道的回答下..设函数f(x)对任意实数都有f(3-x)=f(3+x). 2020-06-04 …
如图所示,甲、乙两个实心圆柱体放在水平地面上,它们的高度分别为h甲、h乙,底面积分别为S甲、S乙, 2020-06-15 …
符号“H”表示一种运算,它对正整数的运算结果如下:H(1)=-2,H(2)=3,H(3)=-4,H 2020-07-18 …
(2014•重庆)已知直线ax+y-2=0与圆心为C的圆(x-1)2+(y-a)2=4相交于A,B 2020-07-21 …
设函数f《x》={X}^{2}-mlnx,h《x》=x2-x+a《1》当a=0.f《x》大于等于h 2020-07-27 …
已知函数f(x)=x^2-mlnx,h(x)=x^2-x+a(1)当a=0时,f(x)>=h(x)在 2020-10-31 …
(她414•内江模拟)设函数p(x)=13x3-ax(a>4),g(x)=bx她+她b-1.(1)若 2020-11-12 …
如表是探究温度对酵母菌种群密度(个/mL)影响的实验结果,下列有关叙述正确的是()时间种群密度温度0 2020-12-04 …