早教吧作业答案频道 -->化学-->
碳、氮、氟、硅、铁、钛等元素的化合物广泛应用于生产生活,回答下列问题:(1)基态Si原子中,电子占据的最高能层具有的原子轨道数为,1mol氮气分子中σ键和π键的物质的量之比为
题目详情
碳、氮、氟、硅、铁、钛等元素的化合物广泛应用于生产生活,回答下列问题:
(1)基态Si原子中,电子占据的最高能层具有的原子轨道数为___,1mol氮气分子中σ键和π键的物质的量之比为___;基态钛原子的价电子排布式为___.
(2)C、N、F三种元素电负性由大到小的顺序为___.第二周期元素中第一电离能介于B、F之间的有___种.
(3)NF3分子的空间构型为三角锥型,N原子的杂化轨道类型为___.
(4)已知铁的单质有如图1所示的两种常见堆积方式,其中属于面心立方最密堆积的是___(填a或b)
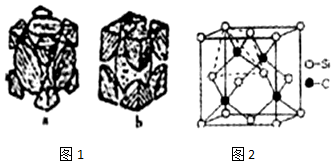
(5)金刚砂(SiC)的硬度仅次于金刚石,其晶胞结构如图2所示,金刚砂晶体类型为___,每个C原子周围最近的C原子数目为___,若晶胞的边长为a cm,阿伏伽德罗常数为 NA,则金刚砂的密度为___g•cm-3(不需要化简)
(1)基态Si原子中,电子占据的最高能层具有的原子轨道数为___,1mol氮气分子中σ键和π键的物质的量之比为___;基态钛原子的价电子排布式为___.
(2)C、N、F三种元素电负性由大到小的顺序为___.第二周期元素中第一电离能介于B、F之间的有___种.
(3)NF3分子的空间构型为三角锥型,N原子的杂化轨道类型为___.
(4)已知铁的单质有如图1所示的两种常见堆积方式,其中属于面心立方最密堆积的是___(填a或b)

(5)金刚砂(SiC)的硬度仅次于金刚石,其晶胞结构如图2所示,金刚砂晶体类型为___,每个C原子周围最近的C原子数目为___,若晶胞的边长为a cm,阿伏伽德罗常数为 NA,则金刚砂的密度为___g•cm-3(不需要化简)
▼优质解答
答案和解析
(1)硅质子数为14,基态Si原子的核外电子排布式为1s22s22p63s23p2,最高能层3s、3p、3d具有的原子轨道数为1+3+5=9,每个氮气分子中有一个σ键和2个π键,所以1mol氮气分子中σ键和π键的物质的量之比为1:2,Ti是22号元素,核外电子排布式为1s22s22p63s23p63d24s2,价电子排布式为为3d24s2,
故答案为:9;1:2;3d24s2;
(2)同一周期元素,元素电负性随着原子序数增大而增大,所以C、N、F三种元素电负性由大到小的顺序为F>N>C,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第二周期元素中第一电离能介于B、F之间的有Be、C、N、O,共4种,
故答案为:F>N>C;4;
(3)根据价层电子对理论知,NF3分子中N原子价层电子对个数=
=4,所以N原子采用sp3杂化,
故答案为:sp3;
(4)由图可知,a为面心立方最密堆积,b为体心立方最密堆积,
故答案为:a;
(5)金刚砂硬度大,晶胞中Si、C原子之间形成共价键,为空间网状结构,属于原子晶体,晶胞中存在四面体构型,晶胞中Si、C原子位置可以互换,互换后以顶点C原子为研究对象,与之最近的C原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,故每个C原子周围最近的C原子数目为
=12,晶胞中Si处于顶点与面心,晶胞中Si元素数目为8×
+6×
=4,C原子处于晶胞内部,晶胞中C原子数目为4,故晶胞质量为4×
g,晶胞体积为(a cm)3,则晶胞密度为4×
g÷(a cm)3=
g•cm-3,
故答案为:原子晶体;12;
.
故答案为:9;1:2;3d24s2;
(2)同一周期元素,元素电负性随着原子序数增大而增大,所以C、N、F三种元素电负性由大到小的顺序为F>N>C,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第二周期元素中第一电离能介于B、F之间的有Be、C、N、O,共4种,
故答案为:F>N>C;4;
(3)根据价层电子对理论知,NF3分子中N原子价层电子对个数=
| 5+3 |
| 2 |
故答案为:sp3;
(4)由图可知,a为面心立方最密堆积,b为体心立方最密堆积,
故答案为:a;
(5)金刚砂硬度大,晶胞中Si、C原子之间形成共价键,为空间网状结构,属于原子晶体,晶胞中存在四面体构型,晶胞中Si、C原子位置可以互换,互换后以顶点C原子为研究对象,与之最近的C原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,故每个C原子周围最近的C原子数目为
| 3×8 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 40 |
| NA |
| 40 |
| NA |
| 160 |
| NAa3 |
故答案为:原子晶体;12;
| 160 |
| NAa3 |
看了 碳、氮、氟、硅、铁、钛等元素...的网友还看了以下:
下列说法正确的是()A.液化石油气和天然气的主要成分都是甲烷B.苯分子中的6个碳原子之间的键完全相 2020-04-09 …
有机物在生产生活中扮演着重要的角色,研究有机物具有重要的意义.资料乙烯的比例模型如图1所示.实验测 2020-06-11 …
依据图判断,下列说法正确的是()A.氢气的燃烧热为△H=-241.8kJmol-1B.H2O(g) 2020-06-14 …
哎,又做出问题了.帮忙啦.谢谢设某个厂商,商品总产量的函数Tp=72L-15L的平方-l的三次方. 2020-07-03 …
厂商用资本K和劳动L生产X,在短期中资本是固定的劳动是可变的.短期生产函数是Q=-L3+24,Q是 2020-07-06 …
关于价键理论的一点问题,请众高手帮忙.谢谢!1.为什么π键和大π键的形成不会对分子的几何构型产生显 2020-07-07 …
有机物在生产生活中扮演着重要的角色,研究有机物具有重要的意义.资料乙烯的比例模型如图1所示.实验测 2020-07-10 …
如图所示,L是不计电阻的电感器,C是电容器,闭合电键K,待电路达到稳定状态后,再断开电键K,LC电 2020-07-25 …
某厂生产产品x件的总成本c(x)=1200+2/75*x^3(万元),已知产品单价P(万元)与产品 2020-07-26 …
l-valuespecifiesconstobject中的l-value的具体意思?关键是要将L的意 2020-11-01 …