早教吧作业答案频道 -->化学-->
用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.(1)Fe还原水体中NO3-的反应原理如图1所示.正极的电极反应式是.(2)将足量铁粉投入水体中,经24小时测定N
题目详情
用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为境修复研究的热点之一.
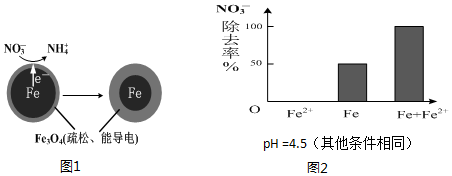
(1)Fe还原水体中NO3-的反应原理如图1所示.正极的电极反应式是___.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
pH=4.5时,NO3-的去除率低.其原因是___.
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:pH=4.5(其他条件相同)
Ⅰ.Fe2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层.
①对比实验,结果如图2所示,可得到的结论是___
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4.结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:___.

(1)Fe还原水体中NO3-的反应原理如图1所示.正极的电极反应式是___.
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 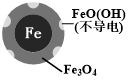 | 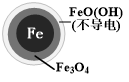 |
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率.对Fe2+的作用提出两种假设:pH=4.5(其他条件相同)
Ⅰ.Fe2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层.
①对比实验,结果如图2所示,可得到的结论是___
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4.结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因:___.
▼优质解答
答案和解析
(1)NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境,则正极的电极反应式为:NO3-+8e-+10H+=NH4++3H2O,
故答案为:NO3-+8e-+10H+=NH4++3H2O;
(2)pH越高,Fe3+越易水解生成FeO(OH),而FeO(OH)不导电,阻碍电子转移,所以NO3-的去除率低,发生离子方程式为:Fe3++2H2O⇌FeO(OH)+3H+,故答案为:FeO(OH)不导电,阻碍电子转移;
(3)①从图2的实验结果可以看出,单独加入Fe2+时,NO3-的去除率为0,因此得出Fe2+不能直接还原NO3-;而Fe和Fe2+共同加入时NO3-的去除率比单独Fe高,因此可以得出结论:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
故答案为:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率;
②同位素示踪法证实了Fe2+能与FeO(OH)反应生成Fe3O4,离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
故答案为:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
故答案为:NO3-+8e-+10H+=NH4++3H2O;
(2)pH越高,Fe3+越易水解生成FeO(OH),而FeO(OH)不导电,阻碍电子转移,所以NO3-的去除率低,发生离子方程式为:Fe3++2H2O⇌FeO(OH)+3H+,故答案为:FeO(OH)不导电,阻碍电子转移;
(3)①从图2的实验结果可以看出,单独加入Fe2+时,NO3-的去除率为0,因此得出Fe2+不能直接还原NO3-;而Fe和Fe2+共同加入时NO3-的去除率比单独Fe高,因此可以得出结论:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率.
故答案为:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率;
②同位素示踪法证实了Fe2+能与FeO(OH)反应生成Fe3O4,离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
故答案为:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移.
看了 用零价铁(Fe)去除水体中的...的网友还看了以下:
1/1,-1/2,-2/1,1/3,2/2,1/3,-1/4,-2/3,-3/2,-4/1,1/5 2020-04-09 …
解方程 1/6{1/4[1/3(1/2x-1)+5}=1解方程1/6{1/4[1/3(1/2x-1 2020-05-16 …
观察按下列规律排成的一列数:1\1,1\2,2\1,1\2,2\2,3\1,1\4,2\3,3\2 2020-06-25 …
某同学在计算3(4+1)(42+1)时,把3写成4-1后,发现可以连续运用两数和乘以这两数差公式计 2020-07-18 …
阅读下列材料:某同学在计算3(4+1)(42+1)时,把3写成4-1后,发现可以连续运用平方差公式 2020-07-18 …
阅读下列材料,完成后面问题某同学在计算3(4+1)(42+1)时,把3写成4-1后,发现可以连续运 2020-07-19 …
口算.560÷7=20×30=2000÷5=70×50=0.6+1.2=20×14=630÷3=2 2020-07-19 …
把3.241、3.2•4•1、3.•2•4、3.2•4、3.24•1按从小到大的顺序排列:2.24 2020-07-19 …
已知矩阵A=(α1α2α3α4)经初等行变换,化为111301120011,则必有()A.α4=α 2020-08-02 …
某同学在计算3(4+1)(42+1)时,把3写成4-1后,发现可以连续运用两数和乘以这两数差公式计 2020-08-02 …