早教吧作业答案频道 -->化学-->
二氧化碳的回收利用是环保领域研究热点.(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为.(2)在催化剂M的作用下,CO2和H2同时发生下列两个反
题目详情
二氧化碳的回收利用是环保领域研究热点.
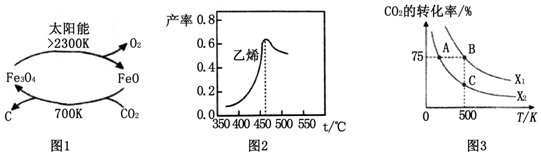
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为___.
(2)在催化剂M的作用下,CO2和H2同时发生下列两个反应:
a.2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g)△H<0
b.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H<0
图2是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因可能是___(填序号).
A.催化剂M的活性降低B.a反应的平衡常数变大
C.生成甲醚的量增加 D.b反应的活化能增大
(3)CO2经过催化氢化合成乙烯反应为:2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g)△H<0
在密闭容器中充入2mol CO2和nmol,在一定条件下发生反应,CO2的转化率与温度、投料比X=[
]的关系如图3所示.
①投料比X1___X2(填“>”、“<”或“=”下同),平衡常数KA、KB、KC的大小关系为___;
②TK时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
20~30min间只改变了某一条件,根据表中的数据判断改变的条件可能是___.该温度下0~10min内H2的反应速率为___.

(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为___.
(2)在催化剂M的作用下,CO2和H2同时发生下列两个反应:
a.2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g)△H<0
b.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H<0
图2是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因可能是___(填序号).
A.催化剂M的活性降低B.a反应的平衡常数变大
C.生成甲醚的量增加 D.b反应的活化能增大
(3)CO2经过催化氢化合成乙烯反应为:2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g)△H<0
在密闭容器中充入2mol CO2和nmol,在一定条件下发生反应,CO2的转化率与温度、投料比X=[
| n(H2) |
| n(CO2) |
①投料比X1___X2(填“>”、“<”或“=”下同),平衡常数KA、KB、KC的大小关系为___;
②TK时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
| 时间/min 浓度/mol•L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.50 | 0.60 | 0.60 |
▼优质解答
答案和解析
(1)在700K条件下,CO2和FeO发生反应生成C和Fe3O4,过程1中Fe3O4分解生成FeO和O2,所以整个反应过程中FeO作催化剂,根据反应物和生成物及反应条件书写方程式为CO2
C+O2,
故答案为:CO2
C+O2;
(2)影响产物产率的因素只能是引起平衡移动的因素,反应的活化能增大因素都是和催化剂有关的因素,催化剂只能改变反应速率,不会引起平衡移动,乙烯产率不会影响,反应的平衡常数变大是温度的变化引起的,反应是放热的,平衡常数变大是因为升高温度,不符合题意,
故选AC;
(3)①相同条件下,投料比[X=
]越大,二氧化碳的转化率越大,根据图知,相同温度下X1的转化率大于X2,所以X1>X2;该反应的正反应是放热反应,温度越高其平衡常数越小,温度A<B,所以平衡常数A>B,A、C温度相同,平衡常数相同,
故答案为:>; KA>KB=KC;
②20~30min间氢气、CO的浓度都增大,且增大倍数相同,应为缩小容器体积,该温度下0~10min内H2浓度变化0.6mol/L,则反应速率为
=0.06mol•L-1•min-1,
故答案为:缩小容器体积; 0.06mol•L-1•min-1.
| ||
| FeO |
故答案为:CO2
| ||
| FeO |
(2)影响产物产率的因素只能是引起平衡移动的因素,反应的活化能增大因素都是和催化剂有关的因素,催化剂只能改变反应速率,不会引起平衡移动,乙烯产率不会影响,反应的平衡常数变大是温度的变化引起的,反应是放热的,平衡常数变大是因为升高温度,不符合题意,
故选AC;
(3)①相同条件下,投料比[X=
| n(H2) |
| n(CO2) |
故答案为:>; KA>KB=KC;
②20~30min间氢气、CO的浓度都增大,且增大倍数相同,应为缩小容器体积,该温度下0~10min内H2浓度变化0.6mol/L,则反应速率为
| 0.6mol/L |
| 10min |
故答案为:缩小容器体积; 0.06mol•L-1•min-1.
看了 二氧化碳的回收利用是环保领域...的网友还看了以下:
《堰塞湖:不期而至的湖泊》的阅读答案1第一段的叙述在全文起什么作用2二三两段都举了堰塞湖的例子,说说 2020-03-30 …
在o二2二,3o二,二2二,二o二中,和o3相等的分数是()A.1525B.315C.525D.5 2020-05-13 …
(2口42•乐山二模)口图,球O夹在锐二面角α-九-β之间,与两个半平面的切点分别为A、一,若A一 2020-05-14 …
(2013•吴中区二模)如图,已知AB是⊙O的直径,C是⊙O上一点,OD⊥BC于点D,过点C作⊙O 2020-05-17 …
一.说出下列符号中“2”的表示意义1、2H2、2H^23、2H4、H^25、O^2-二.1、化合价 2020-06-06 …
直接写8数.37÷8=32二+b8二=1二二二-128=72÷9=3b+1b=2二b×二=2二二× 2020-07-09 …
(2013•香坊区二模)如图,BD是⊙O的直径,OA⊥OB,M是劣弧AB上的一点,过点M作⊙O的切 2020-07-15 …
如图所示,O的直径的长是关于x的二次方程x2+2(k-2)x+k=0(k是整数)的最大整数根.P是 2020-07-31 …
如图所示,⊙O的直径的长是关于x的二次方程x2+2(k-2)x+k=0(k是整数)的最大整数根.P 2020-07-31 …
(2010•长宁区二模)如图,在平面直角坐标系中,以坐标原点O为圆心,2为半径画圆,P是⊙O上一动 2020-08-01 …