早教吧作业答案频道 -->化学-->
我国锑的蕴藏量占世界第一位.某课题组电解三氯化锑水溶液,利用阳极生成的五氯化锑作为浸出剂,对辉锑矿(Sb2S3)进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程
题目详情
我国锑的蕴藏量占世界第一位.某课题组电解三氯化锑水溶液,利用阳极生成的五氯化锑作为浸出剂,对辉锑矿(Sb2S3)进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题.流程如图:
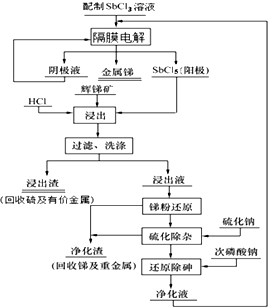
(1)①已知锑最外层有5个电子,锑元素是其所在周期的最后一种金属元素.写出锑元素在周期表中的位置___.
②为配制三氯化锑溶液,取三氯化锑固体少许加2~3mL水溶解,此时却会产生白色沉淀,指出应该如何配制三氯化锑溶液___.
③“工业三废”指的是___.
(2)①电解过程中阳极主要是Sb3+被氧化成Sb5+.请写出阴极的电极反应式___.
②根据流程图写出“浸出”步骤发生反应的化学方程式___.
③已知浸出液中除Sb3+外,还有Cu2+、Pb2+等重金属离子,其中c(Cu2+)=1.6×10-3mol•L-1,向浸出液中加入硫化钠至溶液中的Cu2+刚好沉淀完全,则c(S2-)=___.(已知Ksp(CuS)=8×10-45 Ksp(PbS)=3.4×10-28)
④还原除砷的原理是:以次磷酸钠(Na3PO2)做还原剂,保持微沸温度,使AsCl3被还原为棕色单质砷沉淀,请配平该反应的化学方程式:
___AsCl3+___Na3PO2+___+___H2O=___As↓+3H3PO3+___NaCl.

(1)①已知锑最外层有5个电子,锑元素是其所在周期的最后一种金属元素.写出锑元素在周期表中的位置___.
②为配制三氯化锑溶液,取三氯化锑固体少许加2~3mL水溶解,此时却会产生白色沉淀,指出应该如何配制三氯化锑溶液___.
③“工业三废”指的是___.
(2)①电解过程中阳极主要是Sb3+被氧化成Sb5+.请写出阴极的电极反应式___.
②根据流程图写出“浸出”步骤发生反应的化学方程式___.
③已知浸出液中除Sb3+外,还有Cu2+、Pb2+等重金属离子,其中c(Cu2+)=1.6×10-3mol•L-1,向浸出液中加入硫化钠至溶液中的Cu2+刚好沉淀完全,则c(S2-)=___.(已知Ksp(CuS)=8×10-45 Ksp(PbS)=3.4×10-28)
④还原除砷的原理是:以次磷酸钠(Na3PO2)做还原剂,保持微沸温度,使AsCl3被还原为棕色单质砷沉淀,请配平该反应的化学方程式:
___AsCl3+___Na3PO2+___+___H2O=___As↓+3H3PO3+___NaCl.
▼优质解答
答案和解析
(1)①锑元素属于氮族元素,根据元素的质子数可知电子数为51,核外各电子层电子数为2、8、18、18、5,位于周期表中第五周期第ⅤA族;
故答案为:第五周期第VA族;
②三氯化锑为强酸弱碱盐易水解呈酸性,所以加酸,因其为盐酸盐,所以需加盐酸抑制水解,所以配制三氯化锑溶液:取需要量的三氯化锑固体溶解在较浓的盐酸里,加水稀释到所要的浓度或取需要量的三氯化锑固体溶解并加入少量的盐酸,
故答案为:取需要量的三氯化锑固体溶解在较浓的盐酸里,加水稀释到所要的浓度或取需要量的三氯化锑固体溶解并加入少量的盐酸;
③工业三废包括废气、废水(废液)、废渣,故答案为:废气、废水(废液)、废渣;
(2)①从流程图中可以看出阳极产物为SbCl5,而电解完成后产生金属锑,故阴极反应式为Sb3++3e-=Sb,故答案为:Sb3++3e-=Sb;
②在浸出步骤中具有氧化性的SbCl5和具有还原性的Sb2S3发生氧化还原反应生成不溶性的S单质和SbCl3,故反应方程式为Sb2S3+3SbCl5=5SbCl3+3S;
故答案为:Sb2S3+3SbCl5=5SbCl3+3S;
③Cu2+刚好完全沉淀时c(Cu2+)=1×10-5,由Ksp(CuS)=c(Cu2+)×c(S2-),知c(Cu2+)=
=
=8×10-40,故答案为:8×10-40;
④次磷酸钠(Na3PO2)做还原剂,被氧化为H3PO3,P元素由+1价变为+3价,价态升高2;AsCl3被还原为As单质,As元素由+3价变为0价,价态降低3,所以AsCl3和Na3PO2系数为2:3,根据元素守恒配平化学反应方程式为2AsCl3+3Na3PO2+3HCl+3H2O=2As↓+3H3PO3+9NaCl,
故答案为:2;3;3HCl;3;2;3;9.
故答案为:第五周期第VA族;
②三氯化锑为强酸弱碱盐易水解呈酸性,所以加酸,因其为盐酸盐,所以需加盐酸抑制水解,所以配制三氯化锑溶液:取需要量的三氯化锑固体溶解在较浓的盐酸里,加水稀释到所要的浓度或取需要量的三氯化锑固体溶解并加入少量的盐酸,
故答案为:取需要量的三氯化锑固体溶解在较浓的盐酸里,加水稀释到所要的浓度或取需要量的三氯化锑固体溶解并加入少量的盐酸;
③工业三废包括废气、废水(废液)、废渣,故答案为:废气、废水(废液)、废渣;
(2)①从流程图中可以看出阳极产物为SbCl5,而电解完成后产生金属锑,故阴极反应式为Sb3++3e-=Sb,故答案为:Sb3++3e-=Sb;
②在浸出步骤中具有氧化性的SbCl5和具有还原性的Sb2S3发生氧化还原反应生成不溶性的S单质和SbCl3,故反应方程式为Sb2S3+3SbCl5=5SbCl3+3S;
故答案为:Sb2S3+3SbCl5=5SbCl3+3S;
③Cu2+刚好完全沉淀时c(Cu2+)=1×10-5,由Ksp(CuS)=c(Cu2+)×c(S2-),知c(Cu2+)=
| KSP(CuS) |
| c(S2-) |
| 8×10-45 |
| 1×10-5 |
④次磷酸钠(Na3PO2)做还原剂,被氧化为H3PO3,P元素由+1价变为+3价,价态升高2;AsCl3被还原为As单质,As元素由+3价变为0价,价态降低3,所以AsCl3和Na3PO2系数为2:3,根据元素守恒配平化学反应方程式为2AsCl3+3Na3PO2+3HCl+3H2O=2As↓+3H3PO3+9NaCl,
故答案为:2;3;3HCl;3;2;3;9.
看了我国锑的蕴藏量占世界第一位.某...的网友还看了以下:
关系矩阵的问题,没学过,突然要考模拟试题,请各位帮忙分析下面的简答题设集合A={a,b,c,d}, 2020-05-13 …
设集合x={a,b,c}上的关系R={(a,b),(b,c),(c,c)},求R的自反闭包r(R) 2020-05-17 …
已知A={a,b,c,d}上的关系R={,,,},S={,,},1.求R的自反闭包r(R),对称闭 2020-06-03 …
设A={a,b,c,d},R是A上的等价关系,且R在A上所构成的等价类是{a,b},{c,d}.( 2020-06-03 …
初授官题高冠草堂详细解读以及分析初授官题高冠草堂岑参三十始一命,宦情多欲阑.自怜无旧业,不敢耻微官 2020-06-22 …
判断题:1.若R是集合A上的二元关系,则str(R)是A上的等价关系.2.若R是集合A上的二元关系 2020-07-25 …
社会关注3月,有传言江苏射阳农村商业银行的一个网点将要倒闭,引起了近千群众恐慌挤兑现金。经查实这又是 2020-11-07 …
《渡荆门送别》1.“山随平野尽,江入大荒流”一联中最为精炼传神的是哪两个字?请指出来并作简要评析《渡 2020-11-12 …
.阅读下面这首唐诗,然后解答后面问题。(8分)乡村四月翁卷绿遍山原白满川,子规声里雨如烟。乡村四月闲 2020-12-01 …
下面对文章的语言特点理解错误的一项是[]A.善于运用简洁含蓄,精炼传神的笔墨,生动地刻画人物的性格和 2020-12-22 …