早教吧作业答案频道 -->化学-->
利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO的一种制备流程图如下:已知:Ksp[Zn(OH)2]=1.2×10-17;Zn(OH)2既能溶于强酸,又能溶于强碱.还能溶于氨水,生成[Zn(NH3)4]2+.(1)
题目详情
利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO的一种制备流程图如下:
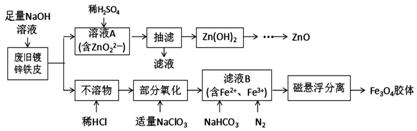
已知:Ksp[Zn(OH)2]=1.2×10-17;Zn(OH)2既能溶于强酸,又能溶于强碱.还能溶于氨水,生成[Zn(NH3)4]2+.
(1)溶液A中加稀H2SO4生成Zn(OH)2的离子方程式为___.
(2)常温下,Zn(OH)2饱和溶液中c(Zn2+)=3×10-6mol/L,若溶液A中加入稀H2SO4过量,会溶解产生的Zn(OH)2,Zn(OH)2开始溶解的pH为___,为防止Zn(OH)2溶解,可将稀H2SO4改为___.(lg2=0.3)
(3)“部分氧化”阶段,NaClO3被还原为Cl-,还原剂与氧化剂反应的物质的量之比是___.
(4)①由溶液B制得Fe3O4胶体粒子的过程中通入N2的原因是___.
②Fe3O4胶体粒子的直径的范围是___.
③确定滤液B中含有Fe2+的试剂是___.
(5)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因___.

已知:Ksp[Zn(OH)2]=1.2×10-17;Zn(OH)2既能溶于强酸,又能溶于强碱.还能溶于氨水,生成[Zn(NH3)4]2+.
(1)溶液A中加稀H2SO4生成Zn(OH)2的离子方程式为___.
(2)常温下,Zn(OH)2饱和溶液中c(Zn2+)=3×10-6mol/L,若溶液A中加入稀H2SO4过量,会溶解产生的Zn(OH)2,Zn(OH)2开始溶解的pH为___,为防止Zn(OH)2溶解,可将稀H2SO4改为___.(lg2=0.3)
(3)“部分氧化”阶段,NaClO3被还原为Cl-,还原剂与氧化剂反应的物质的量之比是___.
(4)①由溶液B制得Fe3O4胶体粒子的过程中通入N2的原因是___.
②Fe3O4胶体粒子的直径的范围是___.
③确定滤液B中含有Fe2+的试剂是___.
(5)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因___.
▼优质解答
答案和解析
(1)溶液A为Na2ZnO2,加稀H2SO4生成Zn(OH)2,离子方程式为ZnO22-+2H+=Zn(OH)2↓;
故答案为:ZnO22-+2H+=Zn(OH)2↓;
(2)已知:Ksp[Zn(OH)2]=1.2×10-17,Zn(OH)2饱和溶液中c(Zn2+)=3×10-6mol/L,Zn(OH)2开始溶解,则c(Zn2+)•c(OH-)2sp[Zn(OH)2],则c(OH-)<
=2×10-6mol/L,故c(H+)>5×10-9mol/L,故pH为8.3时开始溶解,为防止Zn(OH)2溶解,可将稀H2SO4改为弱酸,故可选择通入CO2气体;
故答案为:8.3;CO2;
(3)流程中加人NaClO3氧化部分亚铁离子为铁离子,发生反应为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,还原剂与氧化剂反应的物质的量之比是6:1;
故答案为:6:1;
(4)①持续通入N2,防止Fe2+[或Fe(OH)2]被氧化;
故答案为:防止Fe2+[或Fe(OH)2]被空气(或氧气)氧化;
②胶体微粒直径范围为1~100nm;
故答案为:1~100nm;
③亚铁离子能与K3[Fe(CN)6]溶液生成蓝色沉淀,同时具有还原性,可使酸性高锰酸钾溶液褪色;
故答案为:K3[Fe(CN)6]溶液或酸性高锰酸钾溶液;
(5)根据题意:Zn(OH)2既能溶于强酸,又能溶于强碱,还能溶于氨水,生成[Zn(NH3)4]2+,则可溶性锌盐与氨水反应产生的氢氧化锌要溶于过量的氨水中,生成[Zn(NH3)4]2+,氨水的量不易控制;
故答案为:可溶性锌盐与氨水反应产生的氢氧化锌要溶于过量的氨水中,生成[Zn(NH3)4]2+,氨水的量不易控制.
故答案为:ZnO22-+2H+=Zn(OH)2↓;
(2)已知:Ksp[Zn(OH)2]=1.2×10-17,Zn(OH)2饱和溶液中c(Zn2+)=3×10-6mol/L,Zn(OH)2开始溶解,则c(Zn2+)•c(OH-)2
|
故答案为:8.3;CO2;
(3)流程中加人NaClO3氧化部分亚铁离子为铁离子,发生反应为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,还原剂与氧化剂反应的物质的量之比是6:1;
故答案为:6:1;
(4)①持续通入N2,防止Fe2+[或Fe(OH)2]被氧化;
故答案为:防止Fe2+[或Fe(OH)2]被空气(或氧气)氧化;
②胶体微粒直径范围为1~100nm;
故答案为:1~100nm;
③亚铁离子能与K3[Fe(CN)6]溶液生成蓝色沉淀,同时具有还原性,可使酸性高锰酸钾溶液褪色;
故答案为:K3[Fe(CN)6]溶液或酸性高锰酸钾溶液;
(5)根据题意:Zn(OH)2既能溶于强酸,又能溶于强碱,还能溶于氨水,生成[Zn(NH3)4]2+,则可溶性锌盐与氨水反应产生的氢氧化锌要溶于过量的氨水中,生成[Zn(NH3)4]2+,氨水的量不易控制;
故答案为:可溶性锌盐与氨水反应产生的氢氧化锌要溶于过量的氨水中,生成[Zn(NH3)4]2+,氨水的量不易控制.
看了利用废旧锌铁皮制备磁性Fe3O...的网友还看了以下:
关于溶液物质的量浓度的说法中,正确的是()A将40gNaOH溶入2L水中,c=0.5mol/LB在 2020-04-12 …
一,0.0004mol每升的CaCI2aq里的Ca+2浓度为什么是0.0002mol每升二在0.1 2020-06-04 …
有一可进行电池反应的两个半反应,电极和电解质溶液的物质均相同,但溶液的浓度不同,其电池的电动势() 2020-07-01 …
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率 2020-07-10 …
在一个含有Ba离子和Sr离子的溶液中,钡离子浓度为0.1,锶离子浓度为0.1.在此溶液中,滴入K2 2020-07-13 …
用惰性电极电解400mL一定浓度的CuSO4溶液(不考虑电解过程中溶液体积的变化),通电一段时间后 2020-07-16 …
(1)用惰性电极电解400ml一定浓度的硫酸铜溶液(不考虑电解过程中溶液体积的变化),通电一段时间 2020-07-16 …
已知20℃时,CO2密度为1.83g/L,Ca(OH)2溶解度为0.165g/100gH2O.20 2020-07-18 …
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度 2021-01-13 …
电解质溶液的电导率越大,导电能力越强.用0.100mol/L的NaOH溶液滴定10.00mL浓度均为 2021-01-13 …