早教吧作业答案频道 -->化学-->
某研究性学习小组根据氧化还原反应规律,欲探究NO2、NO与Na2O2反应的情况.I.从理论上分析,Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2
题目详情
某研究性学习小组根据氧化还原反应规律,欲探究NO2、NO与Na2O2反应的情况.
I.从理论上分析,Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;
假设2:NO2氧化Na2O2
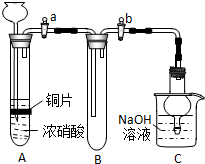
(1)甲同学设计了如图所示装置进行实验.
①试管A中反应的离子方程式___
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃.
(2)乙同学认为甲同学设计的实验存在缺陷并对甲同学的设计进行了改进.他在A、B之间增加了一个装置,然后重复了甲同学的实验操作,观察到红棕色气体迅速消失,但带火星的木条未复燃.乙同学在A、B之间增加的装置的作用是___
(3)根据甲、乙两位的实验及现象,你认为假设___(填“1”或“2”)更合理,NO2 和Na2O2反应的化学方程式为___
Ⅱ.该研究性学习小组还认为NO易与O2发生反应,应该更易被Na2O2氧化.
查阅资料:2NO+Na2O2=2NaNO2; 2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O.酸性条件下,NO能与MnO2反应生成NO3-和Mn2+.
(4)丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应.
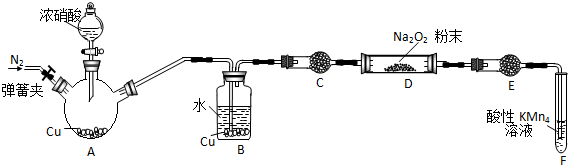
①在反应前,需打开弹簧夹,先通入一段时间N2目的是___
②装置C、E中所盛放的试剂不能___(填字母编号)
A.无水硫酸铜 B.无水氯化钙 C.碱石灰 D.生石灰
③F中发生的氧化剂与还原剂的物质和量之比为___
④充分反应后,检验D装置中产物的方法是:取D装置中产物少许,___则产行中有Na2O2.
I.从理论上分析,Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;
假设2:NO2氧化Na2O2

(1)甲同学设计了如图所示装置进行实验.
①试管A中反应的离子方程式___
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃.
(2)乙同学认为甲同学设计的实验存在缺陷并对甲同学的设计进行了改进.他在A、B之间增加了一个装置,然后重复了甲同学的实验操作,观察到红棕色气体迅速消失,但带火星的木条未复燃.乙同学在A、B之间增加的装置的作用是___
(3)根据甲、乙两位的实验及现象,你认为假设___(填“1”或“2”)更合理,NO2 和Na2O2反应的化学方程式为___
Ⅱ.该研究性学习小组还认为NO易与O2发生反应,应该更易被Na2O2氧化.
查阅资料:2NO+Na2O2=2NaNO2; 2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O.酸性条件下,NO能与MnO2反应生成NO3-和Mn2+.
(4)丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应.

①在反应前,需打开弹簧夹,先通入一段时间N2目的是___
②装置C、E中所盛放的试剂不能___(填字母编号)
A.无水硫酸铜 B.无水氯化钙 C.碱石灰 D.生石灰
③F中发生的氧化剂与还原剂的物质和量之比为___
④充分反应后,检验D装置中产物的方法是:取D装置中产物少许,___则产行中有Na2O2.
▼优质解答
答案和解析
(1)①Cu与浓硝酸反应生成二氧化氮、硝酸铜和水,其反应的离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(2)Cu与浓硝酸反应生成二氧化氮中含有水蒸气,水蒸气能与过氧化钠反应生成氧气,从而对实验目的产生干扰,所以要在A、B之间增加一个装置干燥装置,除去生成NO2气体中混有的水蒸气,故答案为:除去生成NO2气体中混有的水蒸气;
(3)过氧化钠和二氧化氮反应不生成氧气,说明二氧化氮被过氧化钠氧化,所以假设2正确,反应方程式为2NO2+Na2O2=2NaNO3,
故答案为:2;2NO2+Na2O2=2NaNO3;
(4)①空气中的氧气能氧化NO,实验时要排尽装置中的空气,所以在反应前,打开弹簧夹,通入一段时间N2,目的是:将装置中的空气排出;
故答案为:将装置中的空气排出;
②防止水蒸气和过氧化钠反应生成氧气,应该通过C装置除去水蒸气;E是防止F中水蒸气进入D装置,所以CF的目的都是作干燥剂,只有无水硫酸铜不能吸收水分,故选A;
③F中为吸收一氧化氮的反应,其氧化剂为高锰酸根被还原生成二价锰离子降低5价,还原剂为NO被氧化成硝酸根升高3价,则根据得失电子守恒氧化剂与还原剂的物质的量之比为3:5,故答案为:3:5;
④亚硝酸钠中加盐酸会生成NO,NO遇到空气中的氧气会变为红棕色,则检验D装置中物质的方法为:取D装置中产物少许,加入稀盐酸,若产生无色气体,遇到空气变为红棕色,产物是亚硝酸钠;
故答案为:加入稀盐酸,产生红棕色气体.
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(2)Cu与浓硝酸反应生成二氧化氮中含有水蒸气,水蒸气能与过氧化钠反应生成氧气,从而对实验目的产生干扰,所以要在A、B之间增加一个装置干燥装置,除去生成NO2气体中混有的水蒸气,故答案为:除去生成NO2气体中混有的水蒸气;
(3)过氧化钠和二氧化氮反应不生成氧气,说明二氧化氮被过氧化钠氧化,所以假设2正确,反应方程式为2NO2+Na2O2=2NaNO3,
故答案为:2;2NO2+Na2O2=2NaNO3;
(4)①空气中的氧气能氧化NO,实验时要排尽装置中的空气,所以在反应前,打开弹簧夹,通入一段时间N2,目的是:将装置中的空气排出;
故答案为:将装置中的空气排出;
②防止水蒸气和过氧化钠反应生成氧气,应该通过C装置除去水蒸气;E是防止F中水蒸气进入D装置,所以CF的目的都是作干燥剂,只有无水硫酸铜不能吸收水分,故选A;
③F中为吸收一氧化氮的反应,其氧化剂为高锰酸根被还原生成二价锰离子降低5价,还原剂为NO被氧化成硝酸根升高3价,则根据得失电子守恒氧化剂与还原剂的物质的量之比为3:5,故答案为:3:5;
④亚硝酸钠中加盐酸会生成NO,NO遇到空气中的氧气会变为红棕色,则检验D装置中物质的方法为:取D装置中产物少许,加入稀盐酸,若产生无色气体,遇到空气变为红棕色,产物是亚硝酸钠;
故答案为:加入稀盐酸,产生红棕色气体.
看了某研究性学习小组根据氧化还原反...的网友还看了以下:
∑(2^n)/(n^n)的收敛性你回答的是:取后一项后前一项的比.(2^n+1)/((n+1)^(n 2020-03-31 …
(1/(n^2 n 1 ) 2/(n^2 n 2) 3/(n^2 n 3) ……n/(n^2 n 2020-05-16 …
若n为一自然数,说明n(n+1)(n+2)(n+3)与1的和为一平方数n(n+1)(n+2)(n+ 2020-05-16 …
为什么n(n+1)(n+2)可拆成1/4[n(n+1)(n+2)(n+3)-(n-1)n(n+1) 2020-06-22 …
下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是()A.基态原子的N层上只有一个电 2020-10-31 …
一块条形磁铁不慎被摔断,则原来N极那段的断口处()A.形成S极B.没有磁性C.形成N极D.可能为N极 2020-11-01 …
一块条形磁铁不慎被摔断,则原来N极那段的断口处()A.形成S极B.没有磁性C.形成N极D.可能为N极 2020-11-01 …
我们可以通过计算求得:1+2+3+...+n=n*(n+1)除以2,其中n是正整数,现在我们来研究一 2020-12-04 …
若多项式x的4次方×y的n次方-2x³与单项式2x³y²的次数相同,试探究n-2n+3n-4n+…… 2020-12-31 …
赋值语句N=N+1的意义是()A.N等于N+1B.N+1等于NC.将N的值赋给N+1D.将N的原值加 2020-12-31 …