已知锌及其化合物的性质与铝及其化合物相似.现向ZnCl2溶液中逐渐滴加NaOH溶液,溶液的pH与某些离子的浓度关系如图(横坐标为溶液的pH,纵坐标为Zn2+或ZnO22-的物质的量浓度;假设Zn2+的浓
已知锌及其化合物的性质与铝及其化合物相似.现向ZnCl2溶液中逐渐滴加NaOH溶液,溶液的pH与某些离子的浓度关系如图(横坐标为溶液的pH,纵坐标为Zn2+或ZnO22-的物质的量浓度;假设Zn2+的浓度为10 -5mol•L-l时,Zn2+已沉淀完全).则下列说法正确的是( )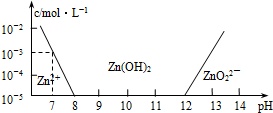
A. pH≥12时,发生反应的离子方程式为Zn2++4OH-=ZnO22-+2H2O
B. 若要使ZnCl2溶液中Zn2+沉淀完全,加入的NaOH溶液越多越好
C. 向1L0.1mol•L-lZnCl2溶液中逐渐滴加NaOH溶液至pH=7,需NaOH 0.2mol
D. 若溶液的温度保持不变,则该温度下Zn(OH)2的溶度积Ksp=10 -17
B、加入的NaOH溶液越多越好,沉淀转化为ZnO22-,所以沉淀又溶解,故B错误;
C、根据图象知,pH=7时,C(Zn2+)=10-3mol/L,即只有部分锌离子生成氢氧化锌沉淀,则加入的n(NaOH)<2n(ZnCl2),故C错误;
D、Zn2+离子浓度为10-5mol•L-1时,Zn2+离子已沉淀完全,当溶液的pH=8.0时,c(Zn2+)=10-5 mol•L-1,c(OH-)=10-6 mol•L-1,Ksp=c(Zn2+).c2(OH-)=10-5•(10-6)2=10-17,故D正确;
故选AD.
∑(2^n)/(n^n)的收敛性你回答的是:取后一项后前一项的比.(2^n+1)/((n+1)^(n 2020-03-31 …
请问这个题目该怎么解?3-1=27-3=413-7=621-13=831-21=10即a2-a1=2 2020-03-31 …
铝是地壳中含量最多的金属元素,在自然界主要以化合态形式存在于氧化铝中.铝土矿的主要成分是Al2O3 2020-05-13 …
已知数列{an}中,a1=1且点pn(an,an+1)(n∈N+)在直线x-y+1=0上,(1)求 2020-05-13 …
(1/(n^2 n 1 ) 2/(n^2 n 2) 3/(n^2 n 3) ……n/(n^2 n 2020-05-16 …
若n为一自然数,说明n(n+1)(n+2)(n+3)与1的和为一平方数n(n+1)(n+2)(n+ 2020-05-16 …
为什么n(n+1)(n+2)可拆成1/4[n(n+1)(n+2)(n+3)-(n-1)n(n+1) 2020-06-22 …
在一个钢质零件上面挖一个洞再用铝填平替换后零件总重减少51牛则填入...在一个钢质零件上面挖一个洞 2020-07-21 …
数论+集合1.证明5个相继的正整数之积不是完全平方数设n≥3,(n-2)(n-1)n(n+1)(n+ 2020-10-31 …
已知数列{a底n}中,a1=a2=1,且an=an-1+an-2(n≥3,n∈n*),设bn=an/ 2020-11-27 …