早教吧作业答案频道 -->化学-->
碳及其化合物有广泛应用(1)工业冶炼铝,以石墨为阳极.阳极反应式为,可能发生副反应有.(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为(3)向75mL4mol•L-1KOH
题目详情
碳及其化合物有广泛应用
(1)工业冶炼铝,以石墨为阳极.阳极反应式为___,可能发生副反应有___.
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为___
(3)向75mL 4mol•L-1KOH溶液中缓慢通入4480mL CO2气体(标准状况)恰好完全被吸收.
①写出该反应的离子方程式:___.
②该吸收溶液中离子浓度大小排序为___.
③常温下,a mol•L-1KHCO3溶液的pH=8,HCO3-的水解常数约等于___.(用含a式表示).
(4)已知:①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)⇌CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=___.
(5)某温度下,发生可逆反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.0kJ•mol-1
①向某容器中充入1.0mol H2O和1.0mol CO (g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下列所示:
相对实验I,实验II可能改变的条件可能是___,该温度下,平衡常数=___.
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.
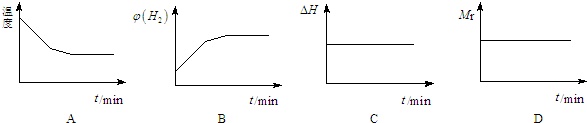
下列图象正确且说明可逆反应达到平衡状态的是___.(填序号)
(1)工业冶炼铝,以石墨为阳极.阳极反应式为___,可能发生副反应有___.
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为___
(3)向75mL 4mol•L-1KOH溶液中缓慢通入4480mL CO2气体(标准状况)恰好完全被吸收.
①写出该反应的离子方程式:___.
②该吸收溶液中离子浓度大小排序为___.
③常温下,a mol•L-1KHCO3溶液的pH=8,HCO3-的水解常数约等于___.(用含a式表示).
(4)已知:①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)⇌CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=___.
(5)某温度下,发生可逆反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.0kJ•mol-1
①向某容器中充入1.0mol H2O和1.0mol CO (g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下列所示:
| 0 | 5min | 10min | 15min | 20min | 25min | |
| Ⅰ(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.
下列图象正确且说明可逆反应达到平衡状态的是___.(填序号)

▼优质解答
答案和解析
(1)电解氧化铝得到铝和氧气,阳极上氧离子失去电子发生氧化反应,电极反应式:2O2--4e-=O2↑;生成的氧气在高温下氧化石墨电极,发生的反应有C+O2
CO2(或2C+O2
2CO),
故答案为:2O2--4e-=O2↑;C+O2
CO2(或2C+O2
2CO);
(2)在酸性介质中CO氧化生成CO2,负极反应式为CO-2e-+H2O=CO2+2H+,
故答案为:CO-2e-+H2O=CO2+2H+;
(3)n(KOH)=0.075L×4mol•L-1=0.3mol,n(CO2)=
=0.2mol,因为二者恰好反应,则反应的离子方程式为2CO2+3OH-=CO32-+HCO3-+H2O,
故答案为:2CO2+3OH-=CO32-+HCO3-+H2O;
②因为碳酸根水解程度大于碳酸氢根,并且水解后都成碱性,所以离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
③因为amol•L-1KHCO3溶液的pH=8,所以pH=10-6mol/L,HCO3-+H2O⇌H2CO3+OH-
c(OH-)=c(H2CO3)=10-6mol/L,水解程度小,消耗HCO3-可忽省不计,所以K=
=
,
故答案为:
;
(4)①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
根据盖斯定律知,①+②×
-③得:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)
△H=-571.6kJ•mol-1-566.0kJ•mol-1×
+90.8kJ•mol-1=-763.8kJ•mol-1,
故答案为:-763.8kJ•mol-1;
(5)①从数据看,I和II达到相同状态,说明平衡没有移动,若该可逆反应是等气体分子数反应,且反应物和产物都是气态,增大压强,平衡不移动,能缩短达到平衡的时间;加入催化剂也能加快反应速率,缩短达到平衡时间;
等气体分子数反应,可以用物质的量代替浓度计算平衡常数,达到平衡时,各物质的物质的量都等于0.5mol,所以K=
=
=1,
故答案为:增大压强(或缩小体积)、加催化剂;1;
②A、开始
| ||
| ||
故答案为:2O2--4e-=O2↑;C+O2
| ||
| ||
(2)在酸性介质中CO氧化生成CO2,负极反应式为CO-2e-+H2O=CO2+2H+,
故答案为:CO-2e-+H2O=CO2+2H+;
(3)n(KOH)=0.075L×4mol•L-1=0.3mol,n(CO2)=
| 4.48L |
| 22.4L/mol |
故答案为:2CO2+3OH-=CO32-+HCO3-+H2O;
②因为碳酸根水解程度大于碳酸氢根,并且水解后都成碱性,所以离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
③因为amol•L-1KHCO3溶液的pH=8,所以pH=10-6mol/L,HCO3-+H2O⇌H2CO3+OH-
c(OH-)=c(H2CO3)=10-6mol/L,水解程度小,消耗HCO3-可忽省不计,所以K=
| C(H2CO3)C(OH-) |
| C(HCO3-) |
| 10-12 |
| a-10-6 |
故答案为:
| 10-12 |
| a-10-6 |
(4)①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
根据盖斯定律知,①+②×
| 1 |
| 2 |
| 3 |
| 2 |
△H=-571.6kJ•mol-1-566.0kJ•mol-1×
| 1 |
| 2 |
故答案为:-763.8kJ•mol-1;
(5)①从数据看,I和II达到相同状态,说明平衡没有移动,若该可逆反应是等气体分子数反应,且反应物和产物都是气态,增大压强,平衡不移动,能缩短达到平衡的时间;加入催化剂也能加快反应速率,缩短达到平衡时间;
等气体分子数反应,可以用物质的量代替浓度计算平衡常数,达到平衡时,各物质的物质的量都等于0.5mol,所以K=
| C(CO2)C(H2) |
| C(CO)C(H2O) |
| 0.5mol×0.5mol |
| 0.5mol×0.5mol |
故答案为:增大压强(或缩小体积)、加催化剂;1;
②A、开始
看了碳及其化合物有广泛应用(1)工...的网友还看了以下:
弧AB、弧CD都是以O为圆心的弧,弧AB的长为π,弧CD的长为5/3π,BD=2,求∠O的度数弧A 2020-05-20 …
对金属制品进行抗腐蚀处理可延长其使用寿命.以下为铝材表面处理的一种方法:铝材→脱脂→碱洗→水洗→除 2020-06-05 …
已知:∠MAN=30°,O为边AN上一点,以O为圆心,2为半径作⊙O,交AN于D、E两点,设AD为 2020-06-17 …
如图,四边形ABCD是菱形,对角线BD上有一点O,以O为圆心,OD长为半径的圆记为O.(1)当O经 2020-06-22 …
(一).对金属制品进行抗腐蚀处理,可延长其使用寿命.以下为铝材表面处理的一种方法:(1)碱洗的目的 2020-06-24 …
如图所示,O为∠BAC平分线上一点,OD⊥AB于D,以O为圆心,以OD为半径作⊙O,求证:⊙O与A 2020-07-11 …
△ABC是一个直角三角形,其中∠C=90゜,∠A=30゜,BC=6;O为AB上一点,且OB=3,⊙ 2020-07-31 …
1,已知正方形ABCD的边长为2,AC和BD相交于点O,过O作EF//AB,分别交BC于E,交AD于 2020-11-02 …
尺规作图,角(锐角)OAB以O为圆心,任意长为半径用圆规画弧,分别叫OA,OB于点C、D.任意画一点 2020-11-26 …
作一个角等于∠AOB,在射线O′A′上,以O′为圆心,以OC长为半径画弧,交O′A′于点C′,再以( 2020-12-09 …