早教吧作业答案频道 -->化学-->
现有25克黄铜矿(主要成分CuFeS2,其它杂质不含铜、铁元素)经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4.某同学通过废铁屑与溶液甲反应,制取补血剂原料FeCO3并回收铜.
题目详情
现有25克黄铜矿(主要成分CuFeS2,其它杂质不含铜、铁元素)经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4.某同学通过废铁屑与溶液甲反应,制取补血剂原料FeCO3并回收铜.主要步骤如图所示:
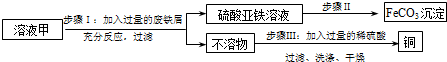
(1)制取补血剂的原料FeCO3中属于微量元素的是___(填元素名称)
(2)步骤Ⅰ中发生化合反应的化学方程式为___.
(3)步骤Ⅱ中加入的一种试剂可能是___(填化学式)
(4)经过上述实验,最终得到34.8g FeCO3和6.4g Cu,若回收过程中,铜的损耗为20%,则原来黄铜矿中CuFeS2的质量分数为多少?(需写出计算过程)

(1)制取补血剂的原料FeCO3中属于微量元素的是___(填元素名称)
(2)步骤Ⅰ中发生化合反应的化学方程式为___.
(3)步骤Ⅱ中加入的一种试剂可能是___(填化学式)
(4)经过上述实验,最终得到34.8g FeCO3和6.4g Cu,若回收过程中,铜的损耗为20%,则原来黄铜矿中CuFeS2的质量分数为多少?(需写出计算过程)
▼优质解答
答案和解析
(1)FeCO3中属于微量元素的是铁元素;(2)步骤Ⅰ中加入的铁能与Fe2(SO4)3反应生成硫酸亚铁,是化合反应;与硫酸、硫酸铜是置换反应;(3)碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是...
看了现有25克黄铜矿(主要成分Cu...的网友还看了以下:
读我国五地海拔及地理位置数据表和图,完成第29—30题。海拔/m纬度经度北京3139°55′N11 2020-04-07 …
读表1数据,回答以下2题。表1我国五地海拔及地理位置海拔/m纬度经度北京3139°55′N116° 2020-04-08 …
读表1数据,回答1-2题。表1我国五地海拔及地理位置海拔/m纬度经度北京3139°55′N116° 2020-04-08 …
关于求逆的.设方阵A满足方程A的平方-A-2E=O(opq的o欧),证明:A及A+2E均可逆,并求 2020-04-27 …
怎样使用matlab解下面的代数方程?急.syms a b c d e;2*b^2=a^2+c^2 2020-05-16 …
翻译一下巴塞罗那(Barcelona)位于伊比利亚半岛东北部,濒临地中海,地理座标位于41°23' 2020-07-01 …
已知函数y=(e^x-a)^2+(e^(-x)-a)^2(a属于R,a不等于0),求y的最小值Y= 2020-07-21 …
我想打积分.对1/(x^2+1)从负无穷积到正无穷.以及对1/(x^2)从0积到1,对1/(x^2) 2020-11-01 …
矩形ABCD,AB=a,AD=b(a>b/2),点E为AD上一动点,EF⊥EC交AB于F,设AE=x 2020-11-02 …
图示人体中血液内糖的来源及去向情况,a到e为发生在人体中的6个生理过程.请你结合学过的知识回答下列问 2020-12-15 …