早教吧作业答案频道 -->化学-->
某同学在实验室研究Fe与H2SO4的反应实验分析(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为.(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止,这一现
题目详情
某同学在实验室研究Fe与H2SO4的反应
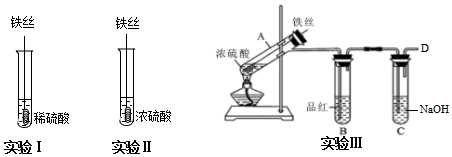
【实验分析】
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为___.
(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止,
这一现象被称为___.
(3)实验Ⅲ,已知:浓H2SO4的沸点为338.2℃,加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体. A中产生的气体是___,装置C的作用是___.
(4)实验Ⅲ结束后,经检验A中既有Fe3+又有大量Fe2+.
①产生Fe2+的原因可能是___(写离子方程式).
②若要检验Fe3+和Fe2+,下列试剂可行的是___(填字母).
A.KSCN、Fe粉B.KSCN、酸性KMnO4溶液C.KSCN、氯水
【实验反思】
(5)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于___,稀硫酸的氧化性源于___.
②影响反应产物多样性的因素有___.

【实验分析】
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为___.
(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止,
这一现象被称为___.
(3)实验Ⅲ,已知:浓H2SO4的沸点为338.2℃,加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体. A中产生的气体是___,装置C的作用是___.
(4)实验Ⅲ结束后,经检验A中既有Fe3+又有大量Fe2+.
①产生Fe2+的原因可能是___(写离子方程式).
②若要检验Fe3+和Fe2+,下列试剂可行的是___(填字母).
A.KSCN、Fe粉B.KSCN、酸性KMnO4溶液C.KSCN、氯水
【实验反思】
(5)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于___,稀硫酸的氧化性源于___.
②影响反应产物多样性的因素有___.
▼优质解答
答案和解析
(1)Fe和稀硫酸反应生成硫酸亚铁和氢气,离子方程式为Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
(2)浓硫酸具有强氧化性,生成致密的氧化膜覆盖在Fe的表面,发生钝化,
故答案为:钝化;
(3)硫酸沸点高、产生气体使品红褪色和D处始终未检测到可燃性气体可推断A中产生的气体为SO2,装置C的作用是吸收SO2防止污染环境,
故答案为:SO2;吸收SO2防止污染环境;
(4)①Fe+2Fe3+=3Fe2+,故有Fe3+又有大量Fe2+
故答案为:Fe+2Fe3+=3Fe2+;
②3SCN-+Fe3+=Fe(SCN)3(血红色),5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,2Fe2++Cl2=2Fe3++2Cl-,
故答案为:B C;
(5))①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性表现在+6价的硫元素上,稀硫酸的氧化性表现在+1价的氢(H+)元素上,
故答案为:+6价S元素,+1价H元素(H+);
②影响反应产物多样性的因素有浓度、温度、反应物的量等
故答案为:浓度、温度、反应物的量等.
故答案为:Fe+2H+=Fe2++H2↑;
(2)浓硫酸具有强氧化性,生成致密的氧化膜覆盖在Fe的表面,发生钝化,
故答案为:钝化;
(3)硫酸沸点高、产生气体使品红褪色和D处始终未检测到可燃性气体可推断A中产生的气体为SO2,装置C的作用是吸收SO2防止污染环境,
故答案为:SO2;吸收SO2防止污染环境;
(4)①Fe+2Fe3+=3Fe2+,故有Fe3+又有大量Fe2+
故答案为:Fe+2Fe3+=3Fe2+;
②3SCN-+Fe3+=Fe(SCN)3(血红色),5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,2Fe2++Cl2=2Fe3++2Cl-,
故答案为:B C;
(5))①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性表现在+6价的硫元素上,稀硫酸的氧化性表现在+1价的氢(H+)元素上,
故答案为:+6价S元素,+1价H元素(H+);
②影响反应产物多样性的因素有浓度、温度、反应物的量等
故答案为:浓度、温度、反应物的量等.
看了 某同学在实验室研究Fe与H2...的网友还看了以下:
哥德巴猜想 ,素数,函数 500分求一个 函数 f(x) 使得 对于 任何一个大于6的正整数 n 2020-05-14 …
关于浮力的题,把体积相同的木块和铁块置于水中,木块浮在水面,铁块沉入水底,这时它们受到的浮力:(A 2020-06-04 …
f(x)为R上偶函数,且满足f(x+2)=-f(x)分之一,当x大于等于2小于等于3时,f(x)= 2020-06-04 …
立体几何7空间四边形ABCD中,D=BC=2,F,G分别为AB,CD的中点,FG=根号3,则AD与 2020-06-27 …
将f(x)按迈克劳林展开=f(0)+f'(0)x+1/2*f''(ξ)x^2,对积分∫1/2*f'' 2020-11-02 …
已知关系式f(x)=1+x分之2,其中f(a)表示x=a时,关系式对应的值,如f(x)=1+x分之2 2020-11-03 …
(2010•达州)将体积相同的实心木球和实心铁球浸没于水中,放手后木球上浮,铁球下沉,静止时它们所受 2020-11-12 …
已知ρ铜>ρ铁>ρ铝,等体积的铜、铁、铝球浸没在水中,受到的浮力()A.F铜浮>F铁浮>F铝浮B.F 2020-11-20 …
关于函数1,定义在R上的函数F(X)满足关系式F(2分之1+X)+F(2分之1-X)=2则F(8分之 2020-12-17 …
下列关于铁的用途中,分别涉及了铁的哪种性质?A、透明度B、导电性C、导热性D、弹性E、硬度F、延展性 2020-12-24 …