早教吧作业答案频道 -->化学-->
白磷是制备高纯度磷酸、烟幕弹、燃烧弹等的重要原料,工业上制备白磷的原理之一为4Ca5(PO4)3F+21Si02+30C⇌3P4+20GaSiO3+30CO↑+SiF4,回答相关问题:(1)基态磷原子的价层电子排布图为,
题目详情
白磷是制备高纯度磷酸、烟幕弹、燃烧弹等的重要原料,工业上制备白磷的原理之一为4Ca5 (PO4)3F+21Si02+30C⇌3P4+20GaSiO3+30CO↑+SiF4,回答相关问题:
(1)基态磷原子的价层电子排布图为___,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为___(用元素符号表示).
(2)上述物质中,中心原子杂化轨道类型为sp3的分子有___,SiF4分子构型为___.若不考虑C的晶体类型,则上述反应过程消失的晶体类型为___.
(3)碳、硅同一主族,CF4沸点比SiF4低的原因是___;碳能形成π键而硅难形成π键的主要原因是___.
(4)图1为硫、磷元素形成的一种分子,分子中每个原子最外层均达到8电子稳定结构,该化合物的分子式为___,若其晶体中分子的堆积方式与干冰相同,则晶体中每个分子的配位数是___.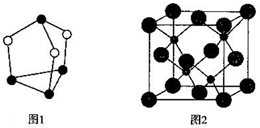
(5)碳、硅两种元素形成的一种高硬度化合物的晶胞如图2所示,若该化合物的密度为ρg•cm3,晶胞参数为a pm,则阿伏加德罗常数为___mol-1.
(1)基态磷原子的价层电子排布图为___,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为___(用元素符号表示).
(2)上述物质中,中心原子杂化轨道类型为sp3的分子有___,SiF4分子构型为___.若不考虑C的晶体类型,则上述反应过程消失的晶体类型为___.
(3)碳、硅同一主族,CF4沸点比SiF4低的原因是___;碳能形成π键而硅难形成π键的主要原因是___.
(4)图1为硫、磷元素形成的一种分子,分子中每个原子最外层均达到8电子稳定结构,该化合物的分子式为___,若其晶体中分子的堆积方式与干冰相同,则晶体中每个分子的配位数是___.

(5)碳、硅两种元素形成的一种高硬度化合物的晶胞如图2所示,若该化合物的密度为ρg•cm3,晶胞参数为a pm,则阿伏加德罗常数为___mol-1.
▼优质解答
答案和解析
(1)P是15号元素,最外层有5个电子,即价层有5个电子,所以价层电子的排布图为 ,上述元素中,位于第二周期的元素为C、O、F,同周期随原子序数增大,元素第一电离能呈增大趋势,注意ⅡA、ⅤA族元素第一电离能高于同周期相邻元素,故第一电离能F>O>C,
,上述元素中,位于第二周期的元素为C、O、F,同周期随原子序数增大,元素第一电离能呈增大趋势,注意ⅡA、ⅤA族元素第一电离能高于同周期相邻元素,故第一电离能F>O>C,
故答案为: ;F>O>C;
;F>O>C;
(2)上述物质中,P4中的磷原子周围有三对共用电子对和一对孤电子对,SiF4中硅原子周围有四对共用电子对,都是sp3杂化,SiF4中硅原子周围有四对共用电子对,没有孤电子对,所以分子构型为正四面体,根据上述反应可知,反应中有二氧化硅为原子晶体,而生成物中没有原子晶体,所以消失的晶体类型为原子晶体,
故答案为:P4、SiF4;正四面体;原子晶体;
(3)碳、硅同一主族,CF4、SiF4都是分子晶体,结构相似,SiF4的相对分子质量大于CF4,SiF4分子间作用力大于CF4,所以SiF4沸点高,硅原子半径比碳原子半径大,所以硅比碳难形成π键,
故答案为:CF4、SiF4都是分子晶体,结构相似,SiF4分子间作用力大于CF4;硅原子半径比碳原子半径大;
(4)根据图1可知,分子中每个原子最外层均达到8电子稳定结构,则空心球为硫原子,实心球为磷原子,所以该化合物的分子式为P4S3,根据干冰晶胞的结构可知,每个二氧化碳分子周围距离最近的二氧化碳分子有12个,所以晶体中每个分子的配位数是12,
故答案:P4S3;12;
(5)根据晶胞的结构图可知,晶胞中含有的碳原子数为4,硅原子数为8×
+6×
=4,根据
可知,NA=
mol-1=
mol-1,
故答案为:
.
 ,上述元素中,位于第二周期的元素为C、O、F,同周期随原子序数增大,元素第一电离能呈增大趋势,注意ⅡA、ⅤA族元素第一电离能高于同周期相邻元素,故第一电离能F>O>C,
,上述元素中,位于第二周期的元素为C、O、F,同周期随原子序数增大,元素第一电离能呈增大趋势,注意ⅡA、ⅤA族元素第一电离能高于同周期相邻元素,故第一电离能F>O>C,故答案为:
 ;F>O>C;
;F>O>C;(2)上述物质中,P4中的磷原子周围有三对共用电子对和一对孤电子对,SiF4中硅原子周围有四对共用电子对,都是sp3杂化,SiF4中硅原子周围有四对共用电子对,没有孤电子对,所以分子构型为正四面体,根据上述反应可知,反应中有二氧化硅为原子晶体,而生成物中没有原子晶体,所以消失的晶体类型为原子晶体,
故答案为:P4、SiF4;正四面体;原子晶体;
(3)碳、硅同一主族,CF4、SiF4都是分子晶体,结构相似,SiF4的相对分子质量大于CF4,SiF4分子间作用力大于CF4,所以SiF4沸点高,硅原子半径比碳原子半径大,所以硅比碳难形成π键,
故答案为:CF4、SiF4都是分子晶体,结构相似,SiF4分子间作用力大于CF4;硅原子半径比碳原子半径大;
(4)根据图1可知,分子中每个原子最外层均达到8电子稳定结构,则空心球为硫原子,实心球为磷原子,所以该化合物的分子式为P4S3,根据干冰晶胞的结构可知,每个二氧化碳分子周围距离最近的二氧化碳分子有12个,所以晶体中每个分子的配位数是12,
故答案:P4S3;12;
(5)根据晶胞的结构图可知,晶胞中含有的碳原子数为4,硅原子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| (apm)3 |
| 4×(12+28) |
| ρ×a×10-30 |
| 1.6×1032 |
| ρa |
故答案为:
| 1.6×1032 |
| ρa |
看了 白磷是制备高纯度磷酸、烟幕弹...的网友还看了以下:
关于物态的问题现在被发现并证实的物态是否只有:固态液态气态等离子态玻色-爱因斯坦凝聚态费米子凝聚态 2020-04-07 …
设NA表示阿伏加德罗常数,下列叙述正确的是()A.1molAlCl3在熔融状态时离子总数为0.4N 2020-05-13 …
制作一个无盖的长方体形塑料盒,塑料盒长0.6米,宽0.4米,高0.5米,预计在制作过重要损耗0.4 2020-05-16 …
2.0molH2(设为理想气体)在恒温(298K)下,自始态反抗200kPa的外压到中间平衡态,然 2020-05-23 …
两个等效p电子形成的原子态,为什么没有单重态1P.完全可以S=0,L=1啊 2020-07-01 …
有关物质状态的问题(急)物质前三态,众所周知,固液气.第四态等离子态第五态玻色-爱因斯坦凝聚态第六 2020-07-11 …
0.5molX元素的离子被还原成中性原子时,需要得到6.02×1023个电子;0.4gX的单质与盐 2020-07-29 …
15*10厚度双面4丝的塑料包装袋不印色料子按照13000元一吨,请问算料子的成本怎么计算我的答案是 2020-12-17 …
问一个很简单的化学题(3)2.0mol的H2(理想气体)在恒温(298K)下,经过下列些途径.从始态 2020-12-22 …
1.制作一个无盖的长方体形塑料盒,塑料盒长0.6m,宽0.4m,高0.5m,预计在制作过程中要损耗0 2020-12-25 …