早教吧作业答案频道 -->化学-->
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.(1)NO2可用水吸收,相应的化学方程式为.利用反应6NO2+8NH3催化剂△7N2+12H2O也可以
题目详情
研究NO2、SO2、CO 等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学方程式为___.利用反应6NO2+8NH3
7N2+12H2O也可以处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是___L.
(2)已知:
2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1
2NO (g)+O2(g)⇌2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO (g) 的△H=___kJ•mol-1,一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___.
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=___.
(3)CO可用于合成甲醇,反应方程式为CO (g)+2H2(g)⇌CH3OH (g).
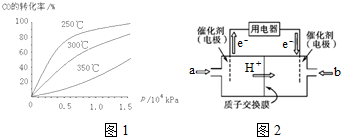
①CO在不同温度下的平衡转化率与压强的关系如图1所示.该反应△H___0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是___.
②甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的___极(填“正”或“负”),其电极反应式为___.

(1)NO2可用水吸收,相应的化学方程式为___.利用反应6NO2+8NH3
| 催化剂 |
| |
| △ |
(2)已知:
2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1
2NO (g)+O2(g)⇌2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO (g) 的△H=___kJ•mol-1,一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___.
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=___.
(3)CO可用于合成甲醇,反应方程式为CO (g)+2H2(g)⇌CH3OH (g).
①CO在不同温度下的平衡转化率与压强的关系如图1所示.该反应△H___0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是___.
②甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的___极(填“正”或“负”),其电极反应式为___.
▼优质解答
答案和解析
(1)NO2与H2O反应的方程式为:3NO2+H2O═2HNO3+NO;6NO2+8NH3═7N2+12H2O,当反应中有1 mol NO2参加反应时,共转移了4 mol电子,故转移12mol电子时,消耗的NO2为12÷4×22.4L=67.2L,
故答案为:3NO2+H2O═2HNO3+NO;67.2;
(2)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=-83.6 kJ•mol-1,则NO2+SO2⇌SO3+NO△H=-41.8 kJ•mol-1;
a.本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态,a错误;
b.随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡,故b正确;
c.SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据,故c错误;
d.d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据,故d错误.
故选b;
NO2(g)+SO2(g)⇌SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即
=
,故x=
a,故平衡常数K=
=
=
=
,
故答案为:-41.8;b;
;
(3)①从横坐标上一点0.5处,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越高转化率越低,说明,升温时平衡向逆向移动.
第二问:实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大.
故答案为:<;在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失;
②根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;O2+4e-+4H+=2H2O.
故答案为:3NO2+H2O═2HNO3+NO;67.2;
(2)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=-83.6 kJ•mol-1,则NO2+SO2⇌SO3+NO△H=-41.8 kJ•mol-1;
a.本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态,a错误;
b.随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡,故b正确;
c.SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据,故c错误;
d.d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据,故d错误.
故选b;
NO2(g)+SO2(g)⇌SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即
| a-x |
| 2a-x |
| 1 |
| 6 |
| 4 |
| 5 |
| c(SO3)•c(NO) |
| c(NO2)•c(SO2) |
| x2 |
| (a-x)(2a-x) |
(
| ||||
|
| 8 |
| 3 |
故答案为:-41.8;b;
| 8 |
| 3 |
(3)①从横坐标上一点0.5处,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越高转化率越低,说明,升温时平衡向逆向移动.
第二问:实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大.
故答案为:<;在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失;
②根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;O2+4e-+4H+=2H2O.
看了研究NO2、SO2、CO等大气...的网友还看了以下:
下列说法正确的是()A.715N+11H→612C+24He是核裂变反应方程B.13H+12H→2 2020-04-05 …
按要求写出方程式.(1)碳酸钙和盐酸(写出离子方程式)(2)氢氧化钡溶液和稀硫酸(写出离子方程式) 2020-04-11 …
解分式方程的基本思路是去分母把分式方程化为方程,在这个方程的变形过程中,有时可能产生不适合原方程的 2020-05-01 …
阅读某同学解分式方程的具体过程,回答后面问题.解方程.解析原方程可化为:检验:当x=-6时,各分母 2020-05-01 …
看图写出等量关系式,并列出方程.(1)等量关系:;方程:.(2)等量关系:;方程:. 2020-05-13 …
已知关于x的方程x2+(m+2)x+2m-1=0.(1)求证:方程有两个不相等的实数根.(2)当m 2020-05-13 …
阅读下面的例题:解方程:x2+|x|-2=0.解:原方程可化为:|x|2+|x|-2=0即:(|x 2020-05-13 …
设,若“方程满足,且方程至少有一根”,就称该方程为“漂亮方程”。则“漂亮方程”的个数为A.8B.1 2020-06-12 …
请阅读下列材料:问题:已知方程x2+x-1=0,求一个一元二次方程,使它的根分别是已知方程根的2倍 2020-06-12 …
设y1,y2,y3是微分方程y″+py′+qy=f(x)的三个线性无关的解,c1,c2为任意常数, 2020-06-30 …