早教吧作业答案频道 -->化学-->
在水体中部分含氮有机物循环如图1所示.(1)图中属于氮的固定的是(填序号).(2)图中①②的转化是在亚硝化细菌和硝化细菌作用下进行的,已知:2NH4+(aq)+3O2═2NO2-(aq)+4H+(aq
题目详情
在水体中部分含氮有机物循环如图1所示.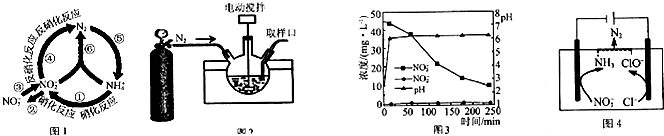
(1)图中属于氮的固定的是___(填序号).
(2)图中①②的转化是在亚硝化细菌和硝化细菌作用下进行的,已知:
2NH4+(aq)+3O2═2NO2-(aq)+4H+(aq)+2H2O(l)△H1=-556.8kj/mol
2NO2-(aq)+O2(g)=2NO3-(aq);△H2=-145.2KJ•mol-1
则反应NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1);
△H3=___KJ•mol-1
(3)某科研机构研究通过化学反硝化的方法除脱水体中过量的NO3-,他们在图示的三颈烧瓶中(装置如图2)中,加入NO3-起始浓度为45mg•L-1的水样、自制的纳米铁粉,起始时pH=2.5,控制水浴温度为25℃、搅拌速率为500转/分,实验中每间隔一定时间从取样口检测水体中NO3-、NO2-及pH(NH4+、N2未检测)的相关数据(如图3).
①实验室可通过反应Fe(H2O)62++2BH4-=Fe↓+2H3BO3+7H2↑制备纳米铁粉,每生成1molFe转移电子总的物质的量为___.
②向三颈烧瓶中通入N2的目的是___.
③开始反应0~20min,pH快速升高到约6.2,原因之一是NO3-还原为NH4+及少量在20~250min时,加入缓冲溶液维持pH6.2左右,NO3-主要还原为NH4+,Fe转化为Fe(OH)2,该反应的离子方程式为___.
(4)一种可以降低水体中NO3-含量的方法是:在废水中加入食盐后用特殊电极进行电解反硝化脱除,原理可用图4简要说明.
①电解时,阴极的电极反应式为___.
②溶液中逸出N2的离子方程式为___.

(1)图中属于氮的固定的是___(填序号).
(2)图中①②的转化是在亚硝化细菌和硝化细菌作用下进行的,已知:
2NH4+(aq)+3O2═2NO2-(aq)+4H+(aq)+2H2O(l)△H1=-556.8kj/mol
2NO2-(aq)+O2(g)=2NO3-(aq);△H2=-145.2KJ•mol-1
则反应NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1);
△H3=___KJ•mol-1
(3)某科研机构研究通过化学反硝化的方法除脱水体中过量的NO3-,他们在图示的三颈烧瓶中(装置如图2)中,加入NO3-起始浓度为45mg•L-1的水样、自制的纳米铁粉,起始时pH=2.5,控制水浴温度为25℃、搅拌速率为500转/分,实验中每间隔一定时间从取样口检测水体中NO3-、NO2-及pH(NH4+、N2未检测)的相关数据(如图3).
①实验室可通过反应Fe(H2O)62++2BH4-=Fe↓+2H3BO3+7H2↑制备纳米铁粉,每生成1molFe转移电子总的物质的量为___.
②向三颈烧瓶中通入N2的目的是___.
③开始反应0~20min,pH快速升高到约6.2,原因之一是NO3-还原为NH4+及少量在20~250min时,加入缓冲溶液维持pH6.2左右,NO3-主要还原为NH4+,Fe转化为Fe(OH)2,该反应的离子方程式为___.
(4)一种可以降低水体中NO3-含量的方法是:在废水中加入食盐后用特殊电极进行电解反硝化脱除,原理可用图4简要说明.
①电解时,阴极的电极反应式为___.
②溶液中逸出N2的离子方程式为___.
▼优质解答
答案和解析
(1)分析转化关系可知,氮的固定是指单质变化为化合物的反应,所以图中属于氮的固定的是⑤,
故答案为:⑤;
(2)①2NH4+(aq)+3O2═2NO2-(aq)+4H+(aq)+2H2O(l)△H1=-556.8kj/mol
②2NO2-(aq)+O2(g)=2NO3-(aq);△H2=-145.2KJ•mol-1
依据盖斯定律计算(①+②)×
得到反应NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1)△H3=-351KJ/mol,
故答案为:-351;
(3)①反应Fe(H2O)62++2BH4-=Fe↓+2H3BO3+7H2↑,反应中铁元素化合价+2价降低为0价,B元素化合价为+3价,元素化合价不变,氢元素化合价-1价升高为0价,生成1molFe电子转移8mol,
故答案为:8mol;
②加入缓冲溶液维持pH6.2左右,NO3-主要还原为NH4+,Fe转化为Fe(OH)2,铁消耗氢离子发生腐蚀,酸性溶液中硝酸根离子氧化亚铁离子生成氢氧化亚铁,硝酸根离子被还原为铵根离子,结合电荷守恒和原子守恒配平书写离子方程式为:4Fe+NO3-+5H2O+2H+=4Fe(OH)2+NH4+,
故答案为:4Fe+NO3-+5H2O+2H+=4Fe(OH)2+NH4+;
(4)①电解池中阴极上是NO3-被还原为NH3,失电子发生还原反应,电极反应为NO3-+6H2O+8e-=NH3+9OH-,
故答案为:NO3-+6H2O+8e-=NH3+9OH-;
②氨气被次氯酸根离子氧化生成氮气,反应的离子方程式为:2NH3+3ClO-=N2+3Cl-+3H2O,
故答案为:2NH3+3ClO-=N2+3Cl-+3H2O.
故答案为:⑤;
(2)①2NH4+(aq)+3O2═2NO2-(aq)+4H+(aq)+2H2O(l)△H1=-556.8kj/mol
②2NO2-(aq)+O2(g)=2NO3-(aq);△H2=-145.2KJ•mol-1
依据盖斯定律计算(①+②)×
| 1 |
| 2 |
故答案为:-351;
(3)①反应Fe(H2O)62++2BH4-=Fe↓+2H3BO3+7H2↑,反应中铁元素化合价+2价降低为0价,B元素化合价为+3价,元素化合价不变,氢元素化合价-1价升高为0价,生成1molFe电子转移8mol,
故答案为:8mol;
②加入缓冲溶液维持pH6.2左右,NO3-主要还原为NH4+,Fe转化为Fe(OH)2,铁消耗氢离子发生腐蚀,酸性溶液中硝酸根离子氧化亚铁离子生成氢氧化亚铁,硝酸根离子被还原为铵根离子,结合电荷守恒和原子守恒配平书写离子方程式为:4Fe+NO3-+5H2O+2H+=4Fe(OH)2+NH4+,
故答案为:4Fe+NO3-+5H2O+2H+=4Fe(OH)2+NH4+;
(4)①电解池中阴极上是NO3-被还原为NH3,失电子发生还原反应,电极反应为NO3-+6H2O+8e-=NH3+9OH-,
故答案为:NO3-+6H2O+8e-=NH3+9OH-;
②氨气被次氯酸根离子氧化生成氮气,反应的离子方程式为:2NH3+3ClO-=N2+3Cl-+3H2O,
故答案为:2NH3+3ClO-=N2+3Cl-+3H2O.
看了 在水体中部分含氮有机物循环如...的网友还看了以下:
射击靶的构成分几个区域怎样计环数?是从外向内数1、2、3.10环,还是从内向外数1、2、3.10环 2020-05-16 …
物理题,欢迎解答,谢谢^^光滑圆环固定在竖直面上,光滑圆环固定在竖直面上,环上穿过带孔小球A、B两 2020-06-03 …
如图所示,水平放置的两根固定的光滑硬杆OA、OB之间的夹角为θ,在两杆上各套轻环P、Q,两环用轻绳 2020-06-22 …
成语填空.知道多少都写、、不拘()()()()环毛PS:这个我不确定.可能是()象环().反正可能 2020-06-22 …
竖直平面内有两个半径同为R的圆环,完全重叠在一起.若一个圆环固定另一个圆环做自由落体运动,试写出在 2020-07-20 …
已知:如图,AC平分∠DAB,∠1=∠2,填定下列空白:∵AC平分∠DAB(已知)∴∠1=(角平分 2020-07-23 …
半径为R,单位长度电阻为X的均匀导体环固定在水平面上,圆环中心为O,匀强磁场垂直于水平面方向向下, 2020-07-31 …
(2003•珠海模拟)半径为R的绝缘光滑圆环固定在竖直平面内,环上套有一个带正的小珠子,该装置所在空 2020-11-12 …
(2007•台州模拟)如图所示,半径R=0.50m的光滑圆环固定在竖直平面内.轻质弹簧的一端固定在环 2020-12-14 …
我想知道第一个空是否填定冠词,请说明理由33.Wesawaudienceclappingtheirh 2020-12-20 …