早教吧作业答案频道 -->化学-->
工业上可用下列装置测定黄铁矿(主要成分为FeS2)中硫的质量分数(忽略SO2、H2SO3与氧气的反应)实验的正确操作步骤如下:A.连接好装置,并检查装置的气密性B.称取研细的黄铁矿样品C
题目详情
工业上可用下列装置测定黄铁矿(主要成分为FeS2)中硫的质量分数(忽略SO2、H2SO3与氧气的反应)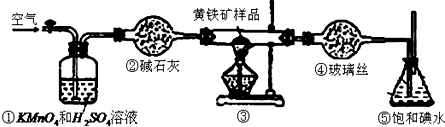
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式___.
(2)步骤G中所用主要仪器是___,应取___(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是___.
(4)装置④的作用是___.
(5)步骤H中滴定时应选用___作指示剂,可以根据___现象来判断滴定已经达到终点.
(6)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
则硫铁矿样品中硫元素的质量分数为___(保留小数点后1位).
(7)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂___.
A.硝酸银溶液 B.氯化钡溶液
C.澄清石灰水 D.酸性高锰酸钾溶液.

实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式___.
(2)步骤G中所用主要仪器是___,应取___(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是___.
(4)装置④的作用是___.
(5)步骤H中滴定时应选用___作指示剂,可以根据___现象来判断滴定已经达到终点.
(6)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
(7)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂___.
A.硝酸银溶液 B.氯化钡溶液
C.澄清石灰水 D.酸性高锰酸钾溶液.
▼优质解答
答案和解析
(1)装置③中FeS2在加热条件下与氧气反应生成二氧化硫知氧化铁,反应的化学方程式为4FeS2+11O2
2Fe2O3+8SO2,
故答案为:4FeS2+11O2
2Fe2O3+8SO2;
(2)萃取、分液的主要仪器为分液漏斗,因为CCl4密度大于水,所以萃取碘后,有机层在下层,水溶液为上层,则后续滴定生成的酸在水溶液中,所以需要取上层水溶液,故答案为:分液漏斗;上;
(3)装置①装有酸性高锰酸钾溶液,具有强氧化性,可氧化除去空气中的还原性气体,提高实验的准确率,
故答案为:除去空气中的还原性气体,提高实验的准确率;
(4)装置④中玻璃丝的作用是过滤二氧化硫气体避免氧化铁颗粒进入,得到平缓的二氧化硫气流,
故答案为:过滤二氧化硫气体避免氧化铁颗粒进入,得到平缓的二氧化硫气流;
(5)根据题意,用氢氧化钠滴定混合强酸溶液,所以常用的指示剂为酚酞,当滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色,说明滴定已经达到终点,
故答案为:酚酞;滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色;
(6)对于多次测量数据一般要求平均值进行数据处理,由于第一次所消耗标准液的体积与后两次相关较大,为减小误差,只求后两次标准液的体积的平均值:20.00ml,根据反应4FeS2+11O2=2Fe2O3+8SO2,I2+SO2+2H2O=2HI+H2SO4,H++OH-═H2O,得关系式S~SO2~4H+~4OH-,所以样品中硫元素的质量为:
mol×32g/mol×
=0.48g,所以样品中硫元素的质量分数为
×100%=24.0%,
故答案为:24.0%;
(7)装置⑤所得溶液为HI、H2SO4的混合溶液,为测得硫的质量分数,最好选用能与SO42-反应生成不溶于酸性溶液的沉淀,即氯化钡符合题意,故选B,
故答案为:B.
| ||
故答案为:4FeS2+11O2
| ||
(2)萃取、分液的主要仪器为分液漏斗,因为CCl4密度大于水,所以萃取碘后,有机层在下层,水溶液为上层,则后续滴定生成的酸在水溶液中,所以需要取上层水溶液,故答案为:分液漏斗;上;
(3)装置①装有酸性高锰酸钾溶液,具有强氧化性,可氧化除去空气中的还原性气体,提高实验的准确率,
故答案为:除去空气中的还原性气体,提高实验的准确率;
(4)装置④中玻璃丝的作用是过滤二氧化硫气体避免氧化铁颗粒进入,得到平缓的二氧化硫气流,
故答案为:过滤二氧化硫气体避免氧化铁颗粒进入,得到平缓的二氧化硫气流;
(5)根据题意,用氢氧化钠滴定混合强酸溶液,所以常用的指示剂为酚酞,当滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色,说明滴定已经达到终点,
故答案为:酚酞;滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色;
(6)对于多次测量数据一般要求平均值进行数据处理,由于第一次所消耗标准液的体积与后两次相关较大,为减小误差,只求后两次标准液的体积的平均值:20.00ml,根据反应4FeS2+11O2=2Fe2O3+8SO2,I2+SO2+2H2O=2HI+H2SO4,H++OH-═H2O,得关系式S~SO2~4H+~4OH-,所以样品中硫元素的质量为:
| 0.020L×0.20mol/L |
| 4 |
| 300ml |
| 20ml |
| 0.48 |
| 2.0 |
故答案为:24.0%;
(7)装置⑤所得溶液为HI、H2SO4的混合溶液,为测得硫的质量分数,最好选用能与SO42-反应生成不溶于酸性溶液的沉淀,即氯化钡符合题意,故选B,
故答案为:B.
看了 工业上可用下列装置测定黄铁矿...的网友还看了以下:
正确抄写:muncanwegooutnowimafraidyoucant二.看音标写单词/dʒu: 2020-05-16 …
帮忙求下这几个的拉氏反变换!(1)1-e^-s(2)1-e^-s/s+2(3)1-e^-2s/s( 2020-05-23 …
某集合S={2,3,7,8}具备以下两个特点:①它的元素都是正整数;②若x∈S,则10-x∈S,我 2020-06-28 …
质量为3千克,2千克的物体栓在生字的两端挂在定滑轮上,不计抹茶和空气的阻力,g取10M/S^2,求 2020-06-29 …
三相异步电动机,一台工作频率为50Hz异步电动机的额定转速为730r/min,其额定转差率s和磁极 2020-07-09 …
S=2/(1×3)+2^2/(3×5)+2^3/(5×7)+…+2^49/(97×99),T=1/ 2020-07-17 …
设S=2/(1×3)+2^2/(3×5)+2^3/(5×7)+…+2^49/(97×99),T=1 2020-07-17 …
S=2/21*3+2^2/3*5+2^3/5*7+……+2^49/97*99,t=1/3+2/5+ 2020-07-17 …
已知S=2/(1*3)+2^2/(3*5)+2^3/(5*7)+……+2^49/(97*99),T 2020-07-20 …
若a,b满足3√a+5√b=7,设S=2√a-3√b,求S的最大值和最小值 2020-11-24 …