早教吧作业答案频道 -->化学-->
氮的固定意义重大,氮肥的大面积使用提高了粮食产量.(1)目前人工固氮有效且有意义的方法是(用一个化学方程式表示).(2)自然界发生的一个固氮反应是N2(g)+O2(g)
题目详情
氮的固定意义重大,氮肥的大面积使用提高了粮食产量.
(1)目前人工固氮有效且有意义的方法是___(用一个化学方程式表示).
(2)自然界发生的一个固氮反应是N2(g)+O2(g)
2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946kJ•mol-1、498kJ•mol-1、632kJ•mol-1,则该反应的△H=___kJ•mol-1.
(3)恒压100kPa时,反应2NO(g)+O2(g)⇌2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)⇌N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2.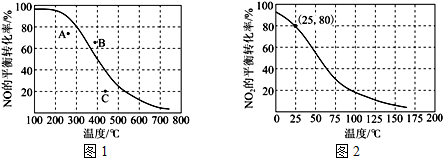
①图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)⇌2NO2(g)达到平衡时NO的转化率,则___点对应的压强最大.
②恒压100kPa、25℃时,2NO2(g)⇌N2O4(g)平衡体系中N2O4的物质的量分数为___,列式计算平衡常数Kp=___.(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)室温下,用注射器吸入一定量NO2气体,将针头插入胶塞密封,然后迅速将气体体积压缩为原来的一半并使活塞固定,此时手握针筒有热感,继续放置一段时间.从活塞固定时开始观察,气体颜色逐渐___(填“变深”或“变浅”),原因是___.[已知2NO2(g)⇌N2O4(g)在几微秒内即可达到化学平衡].
(1)目前人工固氮有效且有意义的方法是___(用一个化学方程式表示).
(2)自然界发生的一个固氮反应是N2(g)+O2(g)
| ||
(3)恒压100kPa时,反应2NO(g)+O2(g)⇌2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)⇌N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2.

①图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)⇌2NO2(g)达到平衡时NO的转化率,则___点对应的压强最大.
②恒压100kPa、25℃时,2NO2(g)⇌N2O4(g)平衡体系中N2O4的物质的量分数为___,列式计算平衡常数Kp=___.(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)室温下,用注射器吸入一定量NO2气体,将针头插入胶塞密封,然后迅速将气体体积压缩为原来的一半并使活塞固定,此时手握针筒有热感,继续放置一段时间.从活塞固定时开始观察,气体颜色逐渐___(填“变深”或“变浅”),原因是___.[已知2NO2(g)⇌N2O4(g)在几微秒内即可达到化学平衡].
▼优质解答
答案和解析
(1)游离态的氮元素反应生成化合态氮元素为氮的固定,如工业合成氨,反应的化学方程式为:N2+3H2
2NH3,
故答案为:N2+3H2
2NH3;
(2)N2(g)+O2(g)
2NO(g),已知N2、O2、NO三种分子中化学键断裂所吸收的能量依次为946kJ•mol-1、498kJ•mol-1、632kJ•mol-1,反应焓变△H=(946kJ•mol-1+498kJ•mol-1)-2×632kJ•mol-1=+180KJ/mol,
故答案为:+180;
(3)①图中曲线上各点为等压不等温,通过控制变量做等温线确定ABC三点与曲线交点等温不等压,从而确定曲线以下的点压强小于100kPa,曲线以上的点压强大于100kPa,所以B点压强最大,
故答案为:B;②利用三段法列式计算,恒压100kPa、25℃时NO2的转化率为80%,设起始量二氧化氮物质的量为x,
2NO2(g)⇌N2O4(g)
起始量(mol) x 0
变化量(mol) 0.8x 0.4x
平衡量(mol) 0.2x 0.4x
平衡体系中N2O4的物质的量分数=
×100%=66.7%,
Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,
则Kp=
故答案为:66.7%;
;
(4)压缩活塞平衡正移,反应放热,针管微热,活塞固定时2NO2(g)⇌N2O4(g)已达平衡状态,放置时气体温度下降,平衡向正反应方向移动,NO2浓度降低,颜色变浅.
故答案为:变浅;活塞固定时2NO2(g)⇌N2O4(g)已达平衡状态,因反应是放热反应,放置时气体温度下降,平衡向正反应方向移动,NO2浓度降低.
| ||
| 高温高压 |
故答案为:N2+3H2
| ||
| 高温高压 |
(2)N2(g)+O2(g)
| ||
故答案为:+180;
(3)①图中曲线上各点为等压不等温,通过控制变量做等温线确定ABC三点与曲线交点等温不等压,从而确定曲线以下的点压强小于100kPa,曲线以上的点压强大于100kPa,所以B点压强最大,
故答案为:B;②利用三段法列式计算,恒压100kPa、25℃时NO2的转化率为80%,设起始量二氧化氮物质的量为x,
2NO2(g)⇌N2O4(g)
起始量(mol) x 0
变化量(mol) 0.8x 0.4x
平衡量(mol) 0.2x 0.4x
平衡体系中N2O4的物质的量分数=
| 0.4x |
| 0.6x |
Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,
则Kp=
| 100kpa×66.7% |
| [100kpa×(1-66.7%)]2 |
故答案为:66.7%;
| 100kpa×66.7% |
| [100kpa×(1-66.7%)]2 |
(4)压缩活塞平衡正移,反应放热,针管微热,活塞固定时2NO2(g)⇌N2O4(g)已达平衡状态,放置时气体温度下降,平衡向正反应方向移动,NO2浓度降低,颜色变浅.
故答案为:变浅;活塞固定时2NO2(g)⇌N2O4(g)已达平衡状态,因反应是放热反应,放置时气体温度下降,平衡向正反应方向移动,NO2浓度降低.
看了 氮的固定意义重大,氮肥的大面...的网友还看了以下:
(6分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。(1)在不同温度下,反应 2020-05-14 …
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。(1)反应需要在闪电或极高温条件 2020-05-14 …
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。(1)已知反应N2(g)+O2( 2020-05-14 …
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.(1)反应需要在闪电或极高温条件 2020-05-14 …
(Ⅰ)(4分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。(1)反应需要在闪 2020-05-14 …
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.(1)在不同温度下,反应N2(g 2020-05-14 …
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.(1)反应需要在闪电或极高温条件 2020-05-14 …
氮的固定意义重大,氮肥的大面积使用提高了粮食产量.(1)目前人工固氮有效且有意义的方法是(用一个化 2020-07-28 …
现有下列十种物质:①液态HNO3②O2③固态K2O④SO3⑤铜⑥熔融态的NaOH⑦分散质粒子直径约 2020-07-29 …
如图所示,转轴O1上固定有两个半径为R和r的轮,用皮带传动O2轮,O2轮的半径是r′,若O1每秒转 2020-07-31 …