早教吧作业答案频道 -->化学-->
甲醇是一种重要的化工原料,又是一种可再生资源,具有开发和应用的广阔前景.(1)已知:CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ/mol2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol①工业上常以甲醇为原
题目详情
甲醇是一种重要的化工原料,又是一种可再生资源,具有开发和应用的广阔前景.
(1)已知:
CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:___.
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的是___.
(2)工业上可用如下方法合成甲醛,化学方程式为CO(g)+2H2(g)=CH3OH(g),已知某些化学键的键能数据如下表:
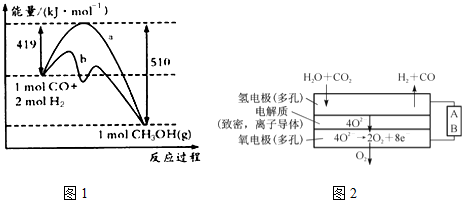
请回答下列问题:
①如图中曲线a到曲线b的措施是___.
②已知CO中的C与O之间为三键,其键能为xkJ/mol,则x=___.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池正极的电极反应式为___.
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶液现象)阳极上收集到氧气的质量为___.
(4)电解水蒸气和CO2产生合成气(H2+CO),较高温度下(700-1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由右图可知A为直流电源的___(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:___.
(1)已知:
CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:___.
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的是___.
(2)工业上可用如下方法合成甲醛,化学方程式为CO(g)+2H2(g)=CH3OH(g),已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |

请回答下列问题:
①如图中曲线a到曲线b的措施是___.
②已知CO中的C与O之间为三键,其键能为xkJ/mol,则x=___.
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池正极的电极反应式为___.
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol/L | 0.5 | 2 | 2 | 0.5 |
(4)电解水蒸气和CO2产生合成气(H2+CO),较高温度下(700-1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2.由右图可知A为直流电源的___(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:___.
▼优质解答
答案和解析
(1)①已知:①CH3OH(g)=HCHO(g)+H2(g)△H=+84kJ/mol;②2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,将2×①+②得到CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式为2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316 kJ•mol-1,
故答案为:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316 kJ•mol-1;
②增大反应物浓度,则使平衡正向移动,提高甲醇的转化率,故答案为:提高甲醇的转化率;
(2)①曲线a到曲线b,活化能降低,应为加入催化剂,故答案为:加入催化剂;
②CO(g)+2H2(g)⇌CH3OH (g)的焓变=反应物总键能之和-生成物总键能之和,设CO中碳氧键的键能为X,结合图表提供的化学键的键能,则△H═X+2×436KJ/mol-(3×413KJ/mol+358KJ/mol+463KJ/mol)=(419-510)kJ•mol-1=-91kJ•mol-1,解得:X=1097KJ/mol,
故答案为:1097;
(3)①①燃料电池,电池的一个电极通 入空气,另一个电极通入甲醇气体,电解质是氢氧化钠溶液,根据原电池原理,正极电极反应是O2得到电子生成氢氧根离子-:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O-4e-=4OH-;
②阴极上显示铜离子得电子,Cu2++2e-=Cu,200mL0.5mol/L的铜离子得电子物质的量是0.2mol,然后是2H++2e-=H2↑,在阳极上是0.4mol氯离子失电子的反应,产生氯气0.2mol,2Cl--2e-=Cl2↑,转移电子是0.4mol,然后是氢氧根离子失电子产生氧气,4OH--4e-=O2↑+2H2O,当两极收集到相同体积(相同条件)的气体时,假设产生氧气的物质的量是x,在阳极上产生气体是(0.2+x)mol,根据电子守恒,得到0.4+4x=0.2+2(0.2+x),解得x=0.1mol,即阳极上收集到氧气的质量为3.2 g,
故答案为:3.2 g;
(4)由图示可知A极水、二氧化碳生成氢气、CO,应发生还原反应,为阴极反应,则A为电源的负极,生成氢气的反应为H2O+2e-=H2↑+O2-,
故答案为:负极;H2O+2e-=H2↑+O2-.
故答案为:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)△H=-316 kJ•mol-1;
②增大反应物浓度,则使平衡正向移动,提高甲醇的转化率,故答案为:提高甲醇的转化率;
(2)①曲线a到曲线b,活化能降低,应为加入催化剂,故答案为:加入催化剂;
②CO(g)+2H2(g)⇌CH3OH (g)的焓变=反应物总键能之和-生成物总键能之和,设CO中碳氧键的键能为X,结合图表提供的化学键的键能,则△H═X+2×436KJ/mol-(3×413KJ/mol+358KJ/mol+463KJ/mol)=(419-510)kJ•mol-1=-91kJ•mol-1,解得:X=1097KJ/mol,
故答案为:1097;
(3)①①燃料电池,电池的一个电极通 入空气,另一个电极通入甲醇气体,电解质是氢氧化钠溶液,根据原电池原理,正极电极反应是O2得到电子生成氢氧根离子-:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O-4e-=4OH-;
②阴极上显示铜离子得电子,Cu2++2e-=Cu,200mL0.5mol/L的铜离子得电子物质的量是0.2mol,然后是2H++2e-=H2↑,在阳极上是0.4mol氯离子失电子的反应,产生氯气0.2mol,2Cl--2e-=Cl2↑,转移电子是0.4mol,然后是氢氧根离子失电子产生氧气,4OH--4e-=O2↑+2H2O,当两极收集到相同体积(相同条件)的气体时,假设产生氧气的物质的量是x,在阳极上产生气体是(0.2+x)mol,根据电子守恒,得到0.4+4x=0.2+2(0.2+x),解得x=0.1mol,即阳极上收集到氧气的质量为3.2 g,
故答案为:3.2 g;
(4)由图示可知A极水、二氧化碳生成氢气、CO,应发生还原反应,为阴极反应,则A为电源的负极,生成氢气的反应为H2O+2e-=H2↑+O2-,
故答案为:负极;H2O+2e-=H2↑+O2-.
看了甲醇是一种重要的化工原料,又是...的网友还看了以下:
已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ/mol,则反应HCl(g)═1 2020-07-18 …
已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1,则反应HCl(g) 2020-07-18 …
已知H2(g)+Cl2(g)=2HCl(g)△H=-92.3kJ•mol-1,则反应2HCl(g) 2020-07-18 …
(1)已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ/mol,则反应HCl(g 2020-07-18 …
已知H2(g)+Cl2(g)=2HCl(g)△H=-92.3kJ?mol-1,则反应2HCl(g) 2020-07-18 …
已知H2(g)+Cl2(g)═2HCl(g)的反应热(△H)等于-183kJ/mol,又知H-H键 2020-07-19 …
已知H2(g)+12O2(g)=H2O(l);△H=─285.8KJ/moL可通过两种途径来完成分 2020-07-19 …
分析某种煤气的体积组成如下:H250%、CH430%、CO10%、N26%、CO24%.已知:H2 2020-07-19 …
已知H2(g)+12O2(g)═H2O(l)△H=-285.8kJ/mol.下列说法不正确的是() 2020-07-19 …
已知H2(g)+12O2(g)═H2O(l)△H=-285.8kJ/mol.下列说法不正确的是() 2020-07-19 …