早教吧作业答案频道 -->化学-->
氨在生活、生产、科研中有广泛用途,而氮的氧化物则是造成大气污染的主要物质.(1)已知:2NH3(g)+3Cl2(g)=N2(g)+6HCl(g)△H=-462kJ/molN2(g)945kJ•mol-1
题目详情
氨在生活、生产、科研中有广泛用途,而氮的氧化物则是造成大气污染的主要物质.
(1)已知:2NH3(g)+3Cl2 (g)=N2(g)+6HCl(g)△H=-462kJ/mol
N2(g)
2N(g)、Cl2(g)
2Cl(g)
则,断开1mol H-N键与断开1mol H-Cl键所需能量相差约为___KJ.
(2)用NH3催化还原NxOy可以消除氮氧化物的污染.如有反应4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H<0,相同条件下在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.
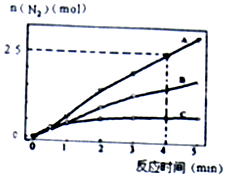
①计算0~4分钟在A催化剂作用下,反应速率 υ(NO)=___;
②下列说法正确的是___;
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)用活性炭还原法的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)调节按下反应,反应进行到不同时间测得各物质的浓度如表:
①30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是___.
②若30min后,在温度不变的情况下,再向容器中充入一定量NO,平衡向___(填“正反应方向”、“逆反应方向”或“不”)移动,达新平衡时NO的体积分数___(填“大于”、“小于”或“等于”)旧平衡时NO的体积分数
③若30min后只升温至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H___0(填“>”、“=”或“<”);从反应开始到T2℃平衡时,NO的转化率为___(保留三位有效数字)
(1)已知:2NH3(g)+3Cl2 (g)=N2(g)+6HCl(g)△H=-462kJ/mol
N2(g)
| 945kJ•mol-1 |
| |
| 243kJ•mol-1 |
| |
则,断开1mol H-N键与断开1mol H-Cl键所需能量相差约为___KJ.
(2)用NH3催化还原NxOy可以消除氮氧化物的污染.如有反应4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H<0,相同条件下在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.

①计算0~4分钟在A催化剂作用下,反应速率 υ(NO)=___;
②下列说法正确的是___;
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.使用催化剂A达平衡时,N2最终产率更大
C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡
(3)用活性炭还原法的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)调节按下反应,反应进行到不同时间测得各物质的浓度如表:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②若30min后,在温度不变的情况下,再向容器中充入一定量NO,平衡向___(填“正反应方向”、“逆反应方向”或“不”)移动,达新平衡时NO的体积分数___(填“大于”、“小于”或“等于”)旧平衡时NO的体积分数
③若30min后只升温至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H___0(填“>”、“=”或“<”);从反应开始到T2℃平衡时,NO的转化率为___(保留三位有效数字)
▼优质解答
答案和解析
(1)设1molH-N键能为x,1molH-Cl键能为y,根据△H=反应物键能之和-生成物键能之和,-462=6x+3×243-(945+6y),x-y=41kJ,
故答案为:41;
(2)①已知4分钟时氮气为2.5mol,则生成的N2为2.5mol,所以v(N2)=
=
=0.3125mol•L-1•min-1,
故答案为:0.3125mol•L-1•min-1;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.使用催化剂A达平衡时,改变反应速率不改变化学平衡,N2最终产率不变,故B错误;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,单位时间内H-O键与N-H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(3)①根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质,故答案为:分离出了二氧化碳;
②向某密闭容器中加入一定量的活性炭和NO,反应生成氮气和二氧化碳,反应的化学方程式为:C+2NO⇌N2+CO2,加入NO反应正向进行,对平衡来说相当于增大压强,反应前后气体体积不变,压强增大平衡不变,达新平衡时NO的体积分数不变,
故答案为:正反应方向;等于;
③30min时,容器中NO、N2、CO2的浓度之比=0.040:0.030:0.030=4:3:3,30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则平衡向逆反应方向移动,所以逆反应是吸热反应,正反应是放热反应,则△H<0,从反应开始到T2℃平衡时设平衡浓度为5x、3x、3x,反应前后气体物质的量不变得到:5x+3x+3x=0.1,x=
,
C+2NO⇌N2+CO2,
起始量(mol/L) 0.1 0 0
变化量(mol/L) 0.1-
平衡量(mol/L)
NO转化率=
×100%=54.5%,
故答案为:<;54.5%.
故答案为:41;
(2)①已知4分钟时氮气为2.5mol,则生成的N2为2.5mol,所以v(N2)=
| △c |
| △t |
| ||
| 4min |
故答案为:0.3125mol•L-1•min-1;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.使用催化剂A达平衡时,改变反应速率不改变化学平衡,N2最终产率不变,故B错误;
C.单位时间内H-O键断裂表示逆速率,N-H键断裂表示正速率,单位时间内H-O键与N-H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(3)①根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质,故答案为:分离出了二氧化碳;
②向某密闭容器中加入一定量的活性炭和NO,反应生成氮气和二氧化碳,反应的化学方程式为:C+2NO⇌N2+CO2,加入NO反应正向进行,对平衡来说相当于增大压强,反应前后气体体积不变,压强增大平衡不变,达新平衡时NO的体积分数不变,
故答案为:正反应方向;等于;
③30min时,容器中NO、N2、CO2的浓度之比=0.040:0.030:0.030=4:3:3,30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则平衡向逆反应方向移动,所以逆反应是吸热反应,正反应是放热反应,则△H<0,从反应开始到T2℃平衡时设平衡浓度为5x、3x、3x,反应前后气体物质的量不变得到:5x+3x+3x=0.1,x=
| 0.1 |
| 11 |
C+2NO⇌N2+CO2,
起始量(mol/L) 0.1 0 0
变化量(mol/L) 0.1-
| 0.5 |
| 11 |
| 0.3 |
| 11 |
| 0.3 |
| 11 |
平衡量(mol/L)
| 0.5 |
| 11 |
| 0.3 |
| 11 |
| 0.3 |
| 11 |
NO转化率=
0.1-
| ||
| 0.1 |
故答案为:<;54.5%.
看了氨在生活、生产、科研中有广泛用...的网友还看了以下:
找出发音相同的单词opposite中第二个o发音相同的是:A.c[o]mpanion[kəmˈpæ 2020-06-06 …
已知圆O:x2+y2=2,直线l:y=kx-2.(1)若直线l与圆O交于不同的两点A,B,当∠AO 2020-06-09 …
已知圆O:x2+y2=1与直线l:y=kx+2(1)当k=2时,求直线l被圆O截得的弦长;(2)当 2020-06-27 …
如果令A、B、C、D……X、Y、Z这26个英文字母,分别等于百分之1、2、3、4、……HARDWO 2020-07-09 …
已知圆O:x2+y2=4,直线l:kx-y-k-1=0(1)判断直线l和圆O的位置关系.(2)求圆 2020-07-18 …
已知O为坐标原点,F(1,0),点P为直线l:x=-1上一动点,点Q为PF的中点,点M满足MQ垂直 2020-07-20 …
已知圆O:x2+y2=2,直线l:y=kx-2。(1)若直线l与圆O相切,求k的值;(2)若直线l 2020-07-30 …
推断题:现有如下反应(反应条件均不给),推断物质⑴A→B+C+D⑵C+E→C+F+D⑶D+G→H⑷ 2020-07-30 …
已知直线L:y=k(x+1)+1与圆O:x^2+y^2=r^2(1)对于任意实数k,直线L与圆O恒有 2020-11-23 …
如果令A、B、C、D……X、Y、Z这26个英文字母,分别等于百分之1、2、3、4、……HARDWOR 2021-02-09 …