早教吧作业答案频道 -->化学-->
电解铝技术的出现与成熟让铝从皇家珍品变成汽车、轮船、航天航空制造等行业的重要材料.工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3等杂质)提取纯Al2O3做冶炼铝的原料,某研究
题目详情
电解铝技术的出现与成熟让铝从皇家珍品变成汽车、轮船、航天航空制造等行业的重要材料.工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3等杂质)提取纯Al2O3做冶炼铝的原料,某研究性学习小组设计了如图提取流程图.
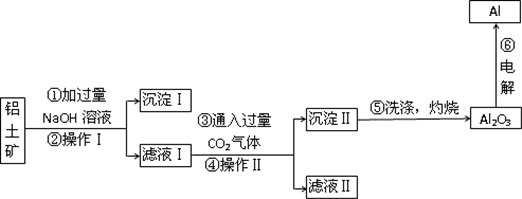
请回答下列问题:
(1)操作Ⅰ和Ⅱ的操作名称是___,所用到的玻璃仪器有___.
(2)铝土矿与氢氧化钠溶液反应的离子方程式为___.
(3)往滤液Ⅰ中通入过量的CO2气体生成沉淀Ⅱ的化学方程式为___.
(4)在实际工业生产流程⑥中需加入冰晶石,目的是___.

请回答下列问题:
(1)操作Ⅰ和Ⅱ的操作名称是___,所用到的玻璃仪器有___.
(2)铝土矿与氢氧化钠溶液反应的离子方程式为___.
(3)往滤液Ⅰ中通入过量的CO2气体生成沉淀Ⅱ的化学方程式为___.
(4)在实际工业生产流程⑥中需加入冰晶石,目的是___.
▼优质解答
答案和解析
铝土矿(主要成分为Al2O3,还有少量的Fe2O3等杂质)中加入氢氧化钠时,氧化铁不溶解,氧化铝溶解,则沉淀Ⅰ为氧化铁,滤液Ⅰ中含有偏铝酸根离子,滤液Ⅰ中通入过二氧化碳,过滤后得沉淀Ⅱ为氢氧化铝固体和滤液Ⅱ为碳酸氢钠溶液,氢氧化铝受热分解得固体氧化铝,氧化铝电解得铝,
(1)操作Ⅰ、Ⅱ都是分离固体和液体,所以操作Ⅰ和Ⅱ的操作名称是过滤,过滤中用到的玻璃仪器有漏斗、烧杯、玻璃棒,
故答案为:过滤;漏斗、烧杯、玻璃棒;
(2)在碱性条件下铝元素以偏铝酸根离子的形式存在,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝和碳酸氢钠,反应的方程式为NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓,
故答案为:NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓;
(4)氧化铝的熔点很高,所以工业电解氧化铝时加入冰晶石可以降低氧化铝的熔点,从而减少冶炼过程中的能量损耗,
故答案为:使氧化铝熔融温度降低,从而减少冶炼过程中的能量损耗.
(1)操作Ⅰ、Ⅱ都是分离固体和液体,所以操作Ⅰ和Ⅱ的操作名称是过滤,过滤中用到的玻璃仪器有漏斗、烧杯、玻璃棒,
故答案为:过滤;漏斗、烧杯、玻璃棒;
(2)在碱性条件下铝元素以偏铝酸根离子的形式存在,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝和碳酸氢钠,反应的方程式为NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓,
故答案为:NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓;
(4)氧化铝的熔点很高,所以工业电解氧化铝时加入冰晶石可以降低氧化铝的熔点,从而减少冶炼过程中的能量损耗,
故答案为:使氧化铝熔融温度降低,从而减少冶炼过程中的能量损耗.
看了 电解铝技术的出现与成熟让铝从...的网友还看了以下:
线性代数 方阵的行列式的性质:请证明方阵的行列式的性质:A,B为方阵,则AB乘积的行列式等于A的行 2020-05-15 …
已知如图,直线y=-根号3x+4根号3与x轴相较于点A,与直线y=根号3x相较于点P.3、动点E从 2020-05-16 …
如图,⊙O是等腰三角形ABC的外接圆,AB=AC,∠A=45°,BD为⊙O的直径,BD与AC相交于 2020-07-17 …
如图所示,以o为圆心的圆周上有六个等分点a、b、c、d、e、f.等量正、负点电荷分别放置在a、d两 2020-07-20 …
已知平面上直线L的方向向量e=(-4/5,3/5)点O(0,0)和A(1,-2)在L上的射影分别是 2020-07-30 …
数学向量题!~已知平面上直线l的方向向量e=(-4/5,3/5),点O(0,0)和A(1,-2)在 2020-07-30 …
(2005•镇江)如图,⊙O是等边三角形ABC的外接圆,D、E是⊙O上两点,则∠D=度,∠E=度. 2020-11-12 …
如图,已知⊙O和⊙O′相交于A、B两点,过点A作⊙O′的切线交⊙O于点C,过点B作两圆的割线分别交⊙ 2020-12-05 …
已知:如图,直线与x轴相交于点A,与直线相交于点P.动点E从原点O出发,以每秒1个单位长度的速度沿着 2020-12-15 …
x+4与x轴相交于点A,与直线y=x相交于点P.(1)求点P的坐标;(2)求S△OPA的值;(3)动 2021-01-11 …