早教吧作业答案频道 -->化学-->
(1)分析反应5NH4NO3═2HNO3+4N2↑+9H2O的电子转移方向和数目(2)在上述反应中发生氧化反应的氮原子与发生还原反应的氮原子的个数比是.(3)在上述反应中每生成1mol硝酸生成N2的体积
题目详情
(1)分析反应5NH4NO3═2HNO3+4N2↑+9H2O的电子转移方向和数目___
(2)在上述反应中发生氧化反应的氮原子与发生还原反应的氮原子的个数比是___.
(3)在上述反应中每生成1mol硝酸生成N2的体积为___L.(标准状况)
(2)在上述反应中发生氧化反应的氮原子与发生还原反应的氮原子的个数比是___.
(3)在上述反应中每生成1mol硝酸生成N2的体积为___L.(标准状况)
▼优质解答
答案和解析
(1)5NH4NO3═2HNO3+4N2↑+9H2O中,铵根离子中N元素化合价由-3价升高为氮气中的0价,共失去15个电子,被还原的氮元素由硝酸根中+5价降低为氮气中的0价,共获得15个电子,用双线桥表示该反应电子转移的方向和数目为: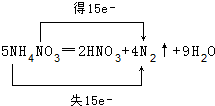 ,故答案为:
,故答案为: ;
;
(2)反应中只有氮元素化合价变化,发生氧化反应的即被氧化的N元素化合价由-3价升高为0价,发生还原反应的即被还原的氮元素由+5价降低为0价,根据电子转移守恒,被氧化与被还原的N原子个数之比为5:3,故答案为:5:3;
(3)由5NH4NO3═2HNO3+4N2↑+9H2O反应,则每生成1mol硝酸生成2molN2即在标准状况的体积为2×22.4=44.8L,故答案为:44.8.
 ,故答案为:
,故答案为: ;
;(2)反应中只有氮元素化合价变化,发生氧化反应的即被氧化的N元素化合价由-3价升高为0价,发生还原反应的即被还原的氮元素由+5价降低为0价,根据电子转移守恒,被氧化与被还原的N原子个数之比为5:3,故答案为:5:3;
(3)由5NH4NO3═2HNO3+4N2↑+9H2O反应,则每生成1mol硝酸生成2molN2即在标准状况的体积为2×22.4=44.8L,故答案为:44.8.
看了(1)分析反应5NH4NO3═...的网友还看了以下:
当n取正整数时,定义N(n)表示n的最大奇因数.如N(1)=1,N(2)=1,N(3)=3,N(4 2020-05-13 …
设函数f(x)=(1+1/n)的n次方(n∈正整数,n大于1,x∈r)1,对于任意x,证明(f(2 2020-05-14 …
用比较申敛法判定收敛性.1+(1+2)/(1+2²)+(1+3)/(1+3²)+...+(1+n² 2020-06-16 …
=.题目详见下面...一、我们知道1/1×2=1/1-1/2=1/2,1/2×3=1/2-1/3= 2020-07-17 …
一、我们知道1/1×2=1/1-1/2=1/2,1/2×3=1/2-1/3=1/6验证:1/3×4 2020-07-17 …
寻找规律解数学题1/1*2=1-1/22/2*3=1/2-1/31/3*4=1/3-1/4……计算 2020-07-22 …
已知数列an的通项公式是an=2*3^(n-1)+(-1)^n*(ln2-ln3)+(-1)^n* 2020-07-30 …
P(n)推导已知p(1)=1;p(n)=(1-1/(n^2))p(n-1)+2/n-1/(n^2) 2020-08-01 …
一道易错数学题数列1,1+2,1+2+4,1+2+4+8,.,1+2+4+8+2^n,求数列的和?我 2020-12-12 …
SQL逐行递增怎么写第一行的值:1+1*n第二行的值:(1+1*n)+(1+1*n)*n第三行的值: 2020-12-15 …