早教吧作业答案频道 -->化学-->
已知:反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H1反应Ⅱ:2NO(g)+O2(g)⇌2NO2(g)△H2(且|△H1|=2|△H2|)反应Ⅲ:4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l)△H3反应I和Ⅱ反应在不
题目详情
已知:反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)⇌2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l)△H3
反应I和Ⅱ反应在不同温度时的平衡常数及其大小关系如表:
(1)①推测反应I是反应___(填“吸热”或“放热”),②150oC时,反应Ⅲ的平衡常数表达式K=___,温度升高,K值___(填“增大”或“减小”).
(2)相同条件下,反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①算0~4分钟在A催化剂作用下,反应速率V(NO)=___,
②下列说法不正确的是___.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.反应达到平衡后,升高温度,逆反应速率先增大后减小
E.由如图1可知,催化剂A使反应进行的程度更大
(3)工业生产的尾气处理中,应用了反应Ⅲ的原理,如图2测得不同温度下氨气的转化率
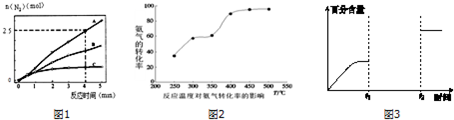
你认为反应控制的最佳温度应为___,
A.300~350℃B.350~400℃
C.400~450℃D.450~500℃
(4)某一体积固定的密闭容器中进行反应Ⅲ,200℃时达平衡.请在如图3补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,N2的百分含量随时间变化图象.
反应Ⅱ:2NO(g)+O2(g)⇌2NO2(g)△H2(且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l)△H3
反应I和Ⅱ反应在不同温度时的平衡常数及其大小关系如表:
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①算0~4分钟在A催化剂作用下,反应速率V(NO)=___,
②下列说法不正确的是___.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.反应达到平衡后,升高温度,逆反应速率先增大后减小
E.由如图1可知,催化剂A使反应进行的程度更大
(3)工业生产的尾气处理中,应用了反应Ⅲ的原理,如图2测得不同温度下氨气的转化率

你认为反应控制的最佳温度应为___,
A.300~350℃B.350~400℃
C.400~450℃D.450~500℃
(4)某一体积固定的密闭容器中进行反应Ⅲ,200℃时达平衡.请在如图3补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,N2的百分含量随时间变化图象.
▼优质解答
答案和解析
(1)①反应I:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H1,平衡常数K1>K1′,升温平衡常数减小,说明平衡逆向进行,正反应为放热反应;
故答案为:放热;
②已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,△H1<0;K2>K2′,说明随温度升高,K减小,则反应II为放热反应,△H2<0;反应I-反应II×3得到反应III,则△H3=△H1-3△H2,已知|△H1|=2|△H2|,所以△H3=△H1-3△H2=|△H2|>0,即反应III为吸热反应,150oC时,反应Ⅲ4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l),的平衡常数表达式K3=
;温度升高平衡正向进行,平衡常数增大,
故答案为:
;增大;
(2)①4min时氮气为2.5mol,则消耗的NO为2.5mol×
=3mol,所以v(NO)=
=0.375mol•L-1•min-1,
故答案为:0.375mol•L-1•min-1;
②A.可逆反应到达平衡时12个O-H断裂,同时生成12个O-H键,而生成12个O-H键需要12个N-H断裂,单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡,故A正确;
B.恒容绝热的密闭容器中,反应中温度会变化,则K会变化,当K值不变时,说明温度不变,反应已经达到平衡,故B正确;
C.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,故活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故C错误;
D.反应达到平衡后,升高温度,速率增大,平衡向逆反应方向进行,逆反应速率从大到小,逆反应速率先增大后减小,故D正确;
E.由如图1可知,催化剂A改变反应速率,不改变化学平衡,不能使反应进行的程度更大,故E正确,
故答案为:CE;
(3)由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,故选C,
故答案为:C;
(4)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加,图象为: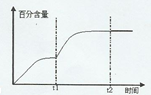 ,
,
答:N2的百分含量随时间变化图象 .
.
故答案为:放热;
②已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,△H1<0;K2>K2′,说明随温度升高,K减小,则反应II为放热反应,△H2<0;反应I-反应II×3得到反应III,则△H3=△H1-3△H2,已知|△H1|=2|△H2|,所以△H3=△H1-3△H2=|△H2|>0,即反应III为吸热反应,150oC时,反应Ⅲ4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l),的平衡常数表达式K3=
| c3(O2)c5(N2) |
| c4(NH3)c6(NO2) |
故答案为:
| c3(O2)c5(N2) |
| c4(NH3)c6(NO2) |
(2)①4min时氮气为2.5mol,则消耗的NO为2.5mol×
| 6 |
| 5 |
| ||
| 4min |
故答案为:0.375mol•L-1•min-1;
②A.可逆反应到达平衡时12个O-H断裂,同时生成12个O-H键,而生成12个O-H键需要12个N-H断裂,单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡,故A正确;
B.恒容绝热的密闭容器中,反应中温度会变化,则K会变化,当K值不变时,说明温度不变,反应已经达到平衡,故B正确;
C.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,故活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故C错误;
D.反应达到平衡后,升高温度,速率增大,平衡向逆反应方向进行,逆反应速率从大到小,逆反应速率先增大后减小,故D正确;
E.由如图1可知,催化剂A改变反应速率,不改变化学平衡,不能使反应进行的程度更大,故E正确,
故答案为:CE;
(3)由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,故选C,
故答案为:C;
(4)t1时升高温度,平衡向正反应方向移动,CO2的百分含量增加,图象为:
 ,
,答:N2的百分含量随时间变化图象
 .
.
看了已知:反应I:4NH3(g)+...的网友还看了以下:
硝酸生产中,500℃时,NH3和O2可能发生如下反应:①4NH3(g)+5O2(g)4NO(g)+ 2020-04-07 …
硝酸生产中,500℃时,NH3和O2可能发生如下反应,若要减少副反应,提高NO的产率,硝酸生产中, 2020-04-07 …
金属元素Cr的一种配位数为6的配合物化学式为CrCl3•6H2O.已知0.01molCrCl3•6 2020-05-13 …
一些烷烃的燃烧热如下表,下列表达正确的是()。A.正戊烷的燃烧热大约在3540kJ⋅mol−1左右 2020-05-14 …
在氨的催化氧化中有副反应发生:4NH3+3O2=2N2+6H2O.已知:4NH3(g)+5O2(g 2020-07-03 …
(6分)丙烷燃烧可以通过以下两种途径:途径I:C3H8(g)+5O2(g)==3CO2(g)+4H 2020-07-09 …
氨的催化氧化4NH3(g)+5O2(g)4NO(g)+6H2O(g)ΔH=-1025kJ·mol-1 2021-02-16 …
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图 2021-02-16 …
图1为某化学反应的速率与时间的关系示意图。下列有关t1时刻改变条件的说法正确的是A.2SO2(g)+ 2021-02-16 …
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位。工业制硝酸的主要反应之一是4NH 2021-02-16 …