常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是()A.A点溶液中加入少量水:c(OH-)c(H2A)增大B.B点:c(HA-)>c(H+
常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )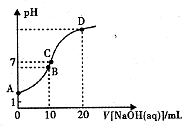
A. A点溶液中加入少量水:
增大c(OH-) c(H2A)
B. B点:c( HA -)>c(H+)>c(A2一)>c(H2A)
C. C点:c(Na+)=c(HA-)+2c( A2-)
D. 水电离出来的c(OH-):B点>D点
| c(OH-) |
| c(H2A) |
B.B点时加入了10mLNaOH溶液,反应后溶质为NaHA,此时溶液的pH小于7,说明HA-的电离程度大于其水解程度,则c(A2-)>c(H2A),由于氢离子还来自水的电离,则c(H+)>c(A2-),溶液中离子浓度大小为:c( HA -)>c(H+)>c(A2-)>c(H2A),故B正确;
C.C点溶液的pH=7,为中性溶液,则c(H+)=c(OH-),根据电荷守恒c(Na+)+c(H+)=c(HA-)+2c( A2-)+c(OH-)可知:c(Na+)=c(HA-)+2c( A2-),故C正确;
D.B点反应后溶质为NaHA,HA-的电离程度大于其水解程度,溶液呈酸性,氢离子抑制了水的电离,而D点加入20mL氢氧化钠溶液,二者恰好反应生成Na2A,A2-水解促进了水的电离,所以水电离的c(OH-):B点<D点,故D错误;
故选D.
如何化简C中的所有项,使得他们保留5位有效数字?%随机生成一个多项式作为测试用例symsnf=sum 2020-03-31 …
平均增长率的公式a(1+x)的n次方=b中的n次方的值应该怎样确定?也就是说,怎样确定n是多少? 2020-05-14 …
在平面直角坐标系中.(1)已知点P(2a-6,a+4)在y轴上,求点P的坐标;(2)已知两点A(- 2020-05-14 …
1×2×3×4…×n+3是自然数的平方数,确定n的值.1%A1%C12%A1%C13%A1%C14 2020-06-04 …
P为抛物线y2=2px上任一点,F为焦点,则以PF为直径的圆与y轴()A.相交B.相切C.相离D. 2020-07-26 …
(1)若点(5-a,a-3)在第一、三象限角平分线上,求a的值;(2)已知两点A(-3,m),B( 2020-08-02 …
确定n,m的值,使下列关于x与y的多项式是一个五次三项式x^n-1y+(3-n)xy^n-2-nx^ 2020-11-03 …
跳高运动员在竖直向上跳起的瞬间,地面对他的弹力的大小为N,他对地面的压力的大小为N′,比较N和N′的 2020-11-22 …
是有关数据结构的一道题怎么算都算不出来试设定若干n的值,比较两函数n2和50nlog2n的增长趋势, 2020-12-31 …
试设定若干n的值,比较两函数n2和50nlog2n的增长趋势,并确定n在什么范围内,函数n2的值大于 2020-12-31 …