早教吧作业答案频道 -->化学-->
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出CH3OH(l)完全燃
题目详情
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.

(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:___.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数的表达式是___,由表中数据判断△H___0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为___,则反应速率v(H2)=___.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)⇌CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的
,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇).
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式___.

(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:___.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为___,则反应速率v(H2)=___.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)⇌CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的
| 1 |
| 2 |
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式___.
▼优质解答
答案和解析
(1)已知CH3OH(l)的燃烧热为-726.5kJ/mol,则CH3OH完全燃烧生成二氧化碳和液态水的热化学方程式为CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1;
(2)①平衡常数为生成物浓度的幂次方之积比上反应物浓度的幂次方之积,则CO(g)+2H2(g)⇌CH3OH(g)反应的平衡常数的表达式K=
,升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:K=
;<;
②CO(g)+2H2(g)⇌CH3OH(g)
开始 1mol/L 3mol/L 0
转化 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=
=2.04,所以是250℃;反应速率v(H2)=
=0.4mol•L-1•min-1,故答案为:250℃;0.4mol•L-1•min-1;
(3)若在t1时刻将容器的体积缩小为原来的
,相当于增大压强,各组分的浓度立即增加原来的一倍,然后是平衡开始正向移动,至t2时刻又达到新的平衡,图示如下: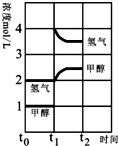 ;故答案为:
;故答案为: ;
;
(4)用CH3OH和空气作燃料电池,用KOH作电解质溶液,负极CH3OH失电子发生氧化反应,则负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
| 3 |
| 2 |
| 3 |
| 2 |
(2)①平衡常数为生成物浓度的幂次方之积比上反应物浓度的幂次方之积,则CO(g)+2H2(g)⇌CH3OH(g)反应的平衡常数的表达式K=
| c(CH 3OH) |
| c(CO)•c 2(H 2) |
故答案为:K=
| c(CH 3OH) |
| c(CO)•c 2(H 2) |
②CO(g)+2H2(g)⇌CH3OH(g)
开始 1mol/L 3mol/L 0
转化 0.8mol/L 1.6mol/L 0.8mol/L
平衡 0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=
| 0.8 |
| 0.2×1.4 2 |
| 1.6mol/L |
| 4min |
(3)若在t1时刻将容器的体积缩小为原来的
| 1 |
| 2 |
 ;故答案为:
;故答案为: ;
;(4)用CH3OH和空气作燃料电池,用KOH作电解质溶液,负极CH3OH失电子发生氧化反应,则负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
看了 煤的气化在煤化工业中占有重要...的网友还看了以下:
已知圆O:x2+y2=2,直线l:y=kx-2.(1)若直线l与圆O交于不同的两点A,B,当∠AO 2020-06-09 …
已知圆O:x2+y2=1与直线l:y=kx+2(1)当k=2时,求直线l被圆O截得的弦长;(2)当 2020-06-27 …
已知圆O:x2+y2=4,直线l:kx-y-k-1=0(1)判断直线l和圆O的位置关系.(2)求圆 2020-07-18 …
在平面直角坐标系xOy中,已知圆O:x2+y2=25,圆O1的圆心为O1(m,0)且与圆O交于点P 2020-07-26 …
已知圆O和圆K是球O的大圆和小圆,其公共弦长等于球O的半径,OK=32,且圆O与圆K所在的平面所成 2020-07-29 …
已知圆O:x2+y2=2,直线l:y=kx-2。(1)若直线l与圆O相切,求k的值;(2)若直线l 2020-07-30 …
已知圆O的直径长为关于x的方程x^2+2(k-2)x+k=0的最大整数根(k为整数)快进来啊已知圆 2020-07-31 …
已知:如图,A,K是圆O上的两点,直线FN垂直于MA,垂足为N,FN与圆O相切与点F,角AOK=2角 2020-10-31 …
已知圆O和圆K是球O的大圆和小圆,其公共弦长等于球O的半径,OK=32,且圆O与圆K所在的平面所成的 2021-02-04 …
高二数学题求助已知抛物线y^2=4x的顶点为o,过点(-1,0)且平行于向量a=(1,k)的直线于抛 2021-02-05 …